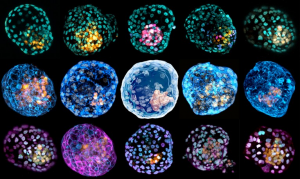
培养系统模拟人类早期发育
早期发育囊胚阶段的胚胎模型,由皮肤细胞重新编程得来。
一些干细胞系统使研究人员能够了解胚胎植入子宫后会发生什么变化。
培养中的细胞通常形成连续的薄片,如皮肤。但在2017年,生物工程师傅建平意识到,如果他在3D支架中培养人类干细胞,它们就会自发地组织成在显微镜下看起来有点像胚胎的结构。基因表达分析表明,这些细胞在植入子宫后立即与胚胎中的细胞相似,这意味着它们可以作为早期发育的实验模型,这在以前一直是盲区。
密歇根大学安娜堡分校(University of Michigan)的研究人员傅建平指出,一旦人类胚胎植入母体子宫,它就会变得不可见。那个时间发生的事情真的是个黑匣子。但这至关重要。这个阶段,大约在人类受精后7到10天,以羊膜囊的形成和原始条纹的最初迹象为标志。该结构标志着胚胎建立身体轴,并开始区分头部和尾部以及左右。
长期以来,研究人员一直试图观察和研究这些发育阶段。但处理人类胚胎在技术和伦理上一直充满挑战。动物模型在模仿人类方面表现不佳。接受生育治疗的人捐赠的天然人类胚胎很难获得。直到今年5月,科学家被禁止在实验室中培养受精后超过两周的此类胚胎。国际干细胞研究协会 (International Society for Stem Cell Research, ISSCR) 在5月放宽了这一为期14天的规定,允许此类工作合法的国家/地区的研究小组申请许可,继续研究超过14天。
鉴于这些限制,研究人员在实验室中寻找天然人类胚胎的替代品也就不足为奇了。长期以来,来自小鼠等物种的干细胞提供了替代品——胚胎干细胞(直接取自早期胚胎)或诱导多潜能干细胞(从成体细胞重新编程)。现在,新一波人类胚胎样模型正在迎头赶上。伦敦弗朗西斯·克里克研究所(Francis Crick Institute)的发育生物学家Naomi Moris表示,如果我们想了解人类特有的特征,我们真的需要研究人类系统。
现在存在各种各样的胚胎样模型。它们包括模拟胚胎植入子宫之前的阶段的类胚细胞和模拟身体计划和器官前体形成的类原肠胚。其它包括胚胎周围的组织,例如卵黄囊和羊膜腔(包围胚胎的充满液体的囊),还有一些概括了大脑、脊髓和心脏形成的早期步骤,发生在人类发育第22天左右。
研究人员仍在评估这些模型与人类胚胎的相似程度——相似性越大,技术和伦理挑战就越大。但它们开辟了新的实验方法。维也纳奥地利科学院分子生物技术研究所(Institute of Molecular Biotechnology of the Austrian Academy of Sciences)发育生物学家 Nicolas Rivron指出,他们第一次能够对与胚胎非常相似的结构进行基因筛选和药物筛选。这样的筛选可以帮助确定发育障碍或不孕症的治疗方法。这些模型还可以帮助梳理器官的形成方式,例如,可能会导致人工移植物的进步。
西班牙巴塞罗那庞培法布拉大学(Pompeu Fabra University)发育生物学家Susanne van den Brink表示,她们使用这些模型,以自下而上的角度研究胚胎学。这就像从最小的零件开始,然后从头开始组装,研究汽车的工作原理。
植入前
最早的发育阶段包括一个名为囊胚的空心细胞球,该阶段发生在植入子宫前,当时人类胚胎包含大约100个细胞。
在2018年之前,囊胚阶段的模型仍处于初级阶段。因此,通过在微孔阵列中组合两种类型的小鼠干细胞,Rivron等人开发了第一个小鼠胚泡——类似于3.5天大的囊胚的自聚集结构。胚细胞由胚胎干细胞和滋养层干细胞形成,揭示了来自胚胎干细胞的信号能调节和诱导滋养层细胞(胎盘的祖细胞)的发育。(后一组细胞在介导子宫着床方面起着至关重要的作用。)Rivron认为,这有点违反直觉,因为在后期发育过程中,是胎盘负责照顾胚胎,但实际上,在这些早期阶段,情况恰恰相反。
几个团队通过在名为AggreWell的3D倒金字塔培养系统中培养干细胞,将人类细胞转化为人胚状模型,该系统可从加拿大温哥华的Stemcell Technologies获得。他们今年报告了他们的发现。例如,达拉斯德克萨斯大学西南医学中心(University of Texas Southwestern Medical Center)的干细胞生物学家Jun Wu等人通过用化学因子处理人类胚胎干细胞来构建胚泡,这些化学因子诱导胚泡发育所需的信号传导。他们发现,同样的方法适用于由重新编程的皮肤细胞产生的人类诱导多潜能干细胞。澳大利亚墨尔本莫纳什大学(Monash University)的干细胞生物学家Xiaodong Liu等人同样想出了一种从人类皮肤细胞形成人类胚细胞的方法。Rivron等人开发了一个人类胚状体模型。
与傅建平等一些人类发育模型不同,胚状体包含在自然人类胚胎中发现的所有三种细胞谱系——不仅是形成胚胎本身的细胞,还包括导致卵黄囊和胎盘的“胚胎外”细胞。吴表示,整个人造胚泡代表了第一个由培养的干细胞建立的完整或整合的胚胎模型。
利用这些,吴开始探索驱动人类发育的分子信号。例如,通过用一种叫做蛋白激酶C的酶的不同版本的抑制剂处理他的胚泡,他已经确定了酶的哪些特定构型能驱动囊胚腔的形成,囊胚腔是位于其中心的充满液体的空间。有关早期发育过程中胚胎和胚胎外组织之间的分子和细胞串扰的问题只能用集成模型(例如胚泡)来回答。
植入及以后
多个小组——包括英国剑桥大学(University of Cambridge)的发育和干细胞生物学家 Magdalena Zernicka-Goetz和北京大学第三医院的发育生物学家杨宇——已经使用人类囊胚模型来观察即将植入之前的阶段(受精后约7-10天)。
这些模型使用扩展的多潜能干细胞,这些干细胞是通过重编程干细胞获得的,因此它们可以生成胚胎和胚胎外细胞谱系。在3D倒金字塔微孔板中培养这些细胞,结合生长和其它化学因素,使细胞聚集成囊胚样结构。
然后,两组都将这些模型扩展到植入后的早期阶段,将它们植入名为Matrigel的3D支架中,该支架模拟细胞周围的蛋白质和化学环境。Zernicka-Goetz指出,[Matrigel]提供信号让这些干细胞组织起来,它使我们能够模拟胚胎植入母亲体内时发生的转变。
傅建平通过使用由三个通道组成的生物工程微流体系统扩展了他的植入后胚胎模型——一个模拟子宫壁的中央凝胶,每个通道都以精确控制的方式传递干细胞和化学信号。他和他的团队在2019的年报告指出,该系统具有足够的可扩展性,可以产生数百甚至数千个胚胎样结构。这种微流体方法还提高了效率和可重复性,使模型特别适用于药物和毒性等转化应用筛选。
傅建平使用他的模型来证明人类胚胎发育的某些方面,例如从干细胞分化形成胎盘最内层(羊膜)的细胞,对植入基质的机械刚度和3D性质特别敏感。改变凝胶基质的厚度或在2D中生长而不是3D培养会阻止正确的羊膜分化。他提醒,到目前为止,这种知识只能从体外模型中产生,因为在体内,很难进行这样的机理研究。
超过 14 天限制
在人类发育的第三周(受精后14-22天),在名为原肠胚形成的过程中会形成身体主干的模式。三个“胚层”也在此阶段形成——产生肠道和内脏器官的内胚层,形成肌肉和结缔组织的中胚层,以及产生皮肤和神经系统的外胚层。康涅狄格州纽黑文市耶鲁大学医学院(Yale School of Medicine)的发育生物学家 Berna Sozen表示,这些胚层是身体所有器官和每种细胞类型的前体,因此了解细胞分化是如何发生的非常重要。
纽约市洛克菲勒大学(Rockefeller University)的发育生物学家Ali Brivanlou和 Eric Siggia于2014年开发了最早的原肠胚模型。Brivanlou指出,这些模型模仿了我们以前从未见过的发育时期,这是最美丽的事情之一。
但那些是二维结构。Van den Brink与剑桥大学的发育生物学家Alfonso Martinez Arias合作,开发了第一个小鼠原肠胚形成的3D模型,名为原肠胚。研究人员发现,培养具有正确信号(例如Wnt信号通路激活剂)的小鼠干细胞的小聚集体,会导致它们分化为类似于原肠胚形成阶段的胚胎样结构。van den Brink表示,它们形成头尾轴、后腹轴和左右轴,它们在正确的位置形成所有器官祖细胞。研究人员以前认为,要形成头尾轴,胚胎必须被胚外组织包围,并接收来自胚外组织的信号,而原肠胚缺乏这种组织。这是一个很好的例子,说明这些模型如何开始挑战我们的胚胎学教科书。
在2020年,作为Martinez Arias的研究生,Moris将该技术转化为人类原肠胚,发现它们的基因表达模式大致“遵循这些结构中的头对尾轴”。
通过将原肠胚形态与现有的人类胚胎精选集合进行比较,Moris的系统能够模拟受精后大约20-21天的胚胎,这个节点上体节的结构开始出现,这些结构会产生脊柱和一些肌肉。这些结构不仅概括了我们知道在哺乳动物发育中发生的事情,而且还让我们在人类发育的时间线中真正确定了它们的位置。因此,这些模型可用于复制人类发育的这些后期阶段。
研究人员现在进一步推动了原肠胚模型。例如,Brivanlou开发了早期人脑组织的3D模型,即神经元。通过在Matrigel中嵌入原肠胚,van den Brink生成了形成体节的小鼠胚胎样模型。德国德累斯顿马克斯普朗克分子细胞生物学和遗传学研究所的发育生物学家 Jesse Veenvliet用体节和神经管(最终形成脊髓的结构)生成了小鼠胚胎样模型。
Veenvliet表示,他们可以使用没有神经管的原始原肠胚作为空白起始模型,然后开始在它上面添加线索,这样他们就可以真正开始正确剖析获得哺乳动物胚胎样所需的最小输入元素。他还指出,研究人员甚至可以捕捉到胚胎发育的过程,并在摄像机上进行直播。
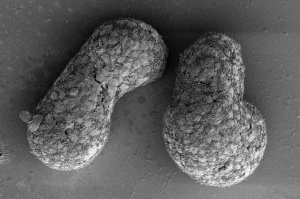
类原肠胚样模型被用于研究身体和器官的形成。
各种应用
这些工具可以帮助研究人员了解发育是如何出错的。例如,从一个人自己的皮肤细胞中创建人类胚胎样模型可以让科学家探索该个体的基因对于发育的影响。
Rivron 等研究人员正在使用子宫内膜的类器官模型来开发详细的植入模型,这可能有助于揭示不孕症和早期流产的原因,并可能导致新的治疗方法。Rivron表示,他们现在可以在一个培养皿中回顾那些通常隐藏在子宫中的过程。
人类胚胎模型也可用于筛选药物毒性。在一项概念验证研究中,Moris表明,沙利度胺(thalidomide)药物——以导致人类先天缺陷而臭名昭著,但对小鼠没有特别毒性——对人类原肠胚的影响比对小鼠原肠胚的影响更大,这表明这些模型可能是可用于特定于人类的毒理学筛选。
傅表示,人类胚胎样模型甚至有朝一日会导致再生医学的进步,例如产生用于移植的人造器官和组织的能力。基于患者来源的多潜能干细胞的模型可以培育出人体识别为自身组织的人造器官。这真的是再生医学里程碑式的成果。
技术和道德挑战
胚胎样模型通常可以使用可购买的、3-9天内的细胞,基于说明书,按照标准的细胞培养技能制成。van den Brink提醒,你必须对细胞进行平板接种,然后给它们正确的信号,但除此之外,大部分时间都在等待。效率通常很低,只有5-20%的细胞集落发育成完全形成的模型,但有些策略做得更好。例如,傅开发的、基于微流体的模型可以超过90% 的成型效率,尽管它们需要专门的生物工程专业知识。
Rivron建议从高质量细胞开始。他认为,拥有原始干细胞绝对是至关重要的。这意味着使用未培养太长时间的细胞,并尽可能保持它们的健康。培养它们是一种艺术。
现有方法提供了一个很好的起点,但要准备好微调实验条件以获得最佳结果。van den Brink指出,如果您在细胞培养方面有经验,那么你可以在大约两周内学会如何制作原肠胚模型。
一旦它们长大,一定要使用显微镜和单细胞基因表达分析对比模型和天然胚胎,以确保它们发育正确。Rivron提醒,外表可能会骗人,你必须能够理解形成的细胞,并将它们与胚胎细胞进行对比。
在第14天之后,此类比较变得更加困难,因为此类实验直到今年早些时候才放开禁令,并且在技术上仍然具有挑战性。但随着技术的改进和实验室可以申请打破14天规则的例外情况,这种现状可能会发生变化。van den Brink表示,这将非常有用,并且肯定会让我们验证人类原肠胚系统。
但伦理考量在胚胎体外生存达到14天后也变得更加复杂。最新的ISSCR指南区分了仅包含部分胚胎的模型(例如原肠胚)和包含所有三种细胞谱系的模型(例如囊胚)。后一种模型想要打破14天原则,将受到与天然胚胎一样严格的监管。参与起草该指南的傅还指出,业内也有共识,不允许将模型用于人类生殖目的。同时,无论模型完整与否,都严禁用于提供移植物的目的。
随着人类胚胎发生模型的改进,进一步的伦理讨论只会变得更加重要。Brivanlou提醒, 这正在以几年前我无法想象的速度向前发育。
原文检索:
Sandeep Ravindran. (2021). Culture Systems Model Early Human Development. Nature, 600: 767-769.
张洁/编译