深入研究神经回路
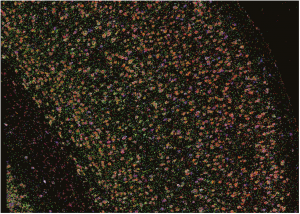
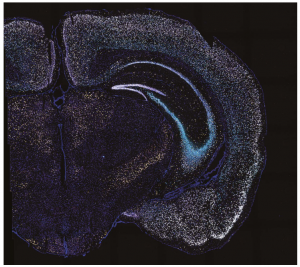
BARseq2技术可以识别信使RNA的片段(荧光),并帮助研究人员了解这些片段所在的大脑皮层。
科学家正在开发越来越精确的工具来实时探测神经元活动、功能和结构。
生活中充满了神经反应:头朝向声音、腿部肌肉在发令枪声中绷紧、口渴的小鼠在被训练成对某种声音作出反应时会向水喷出的方向奔跑。
众所周知,这种与奖励相关的行为背后的机制很难被揭开。神经细胞通常在多个脑区蜿蜒而行,其长长的轴突和密集的树状突起可以与成千上万的邻近细胞交流。神经纤维格外精细,它们的位置是非常关键的:神经网络的中断会导致一系列的神经系统疾病。然而,华盛顿州西雅图艾伦脑科学研究所(Allen Institute for Brain Science in Seattle)的神经科学家Xiaoyin Chen表示,如果科研人员想同时标记几个以上的神经元,并追踪它们的轴突走向,这真的很困难。
尽管如此,研究人员正在慢慢创造出能够破解这种复杂性的工具,利用测序、光遗传学和蛋白质工程的技术来追踪神经元之间的连接,记录它们的活动,测量它们的输入和输出并绘制它们的通讯网络图。
标记细胞的传统方法是使用荧光染料,然后在显微镜下观察它们。但这种技术通常只能跟踪少数几个细胞,因此纽约冷泉港实验室(Cold Spring Harbor Laboratory)的Anthony Zador等人开发了一种工具,可以平行跟踪成千上万个独立的神经元。他们没有使用染料,而是用病毒在每个神经元中插入一个独特的RNA序列,或称“条形码”(barcode)。然后,他们可以通过从靠近病毒注射位置的区域取样,研磨并提取RNA,然后对其进行测序以寻找“条形码”,从而绘制出神经元彼此之间的联系。
Chen表示,这项技术被称为基于测序的投射多重分析(multiplexed analysis of projections by sequencing, MAPseq),于2016年发表,并被广泛认为是对神经通信的高通量绘图的技术突破。但该方法只能粗略地指示轴突的走向,就像提供了县区级的细节,而不是街道地址。而最近作为博士后研究员加入Zador实验室的Chen希望得到更多细节。例如,Chen表示,MAPseq可以告诉他正在研究的神经元位于听觉皮层中,但不能告诉他它们在该区域的六层中的哪一层。
因此,Chen对该技术做了一个关键的改良。他没有从磨碎的大脑切片中对“条形码”进行测序,而是直接在固定的组织中对它们进行测序,从而保留了空间信息。Chen表示,研究人员仍然可以得到相同的投射模式,但在这种情况下,也可以看到细胞所处的位置。
这种方法被称为通过测序解析的“条形码”解剖学,(barcoded anatomy resolved by sequencing, BARseq),它帮助研究人员将投射模式与其它属性联系起来,例如特定基因的表达。例如,Chen等人将其与一种被称为荧光原位杂交(fluorescence in situ hybridization, FISH)的方法以及目标蛋白标记法相结合,以确定不同类型的神经元。
成像升级
今年早些时候,Chen等人将这项技术进一步更新,增加了在整个基因组中分析基因表达的能力。然后,他们使用BARseq2绘制了20种被称为钙粘蛋白(cadherins)的蛋白质的表达图,这些蛋白质有助于指导神经元投射的发育,并且他们发现相似类型的投射表达相似的钙粘蛋白,即使它们来自大脑的不同区域。Chen表示,他们在两个大脑皮层区域发现了相同的信号,这一事实支持了他们的发现,这些信号可能反映了大脑皮层的一般结构,而不仅仅是某些大脑皮层区域的特殊性或人工处理数据。他还补充,在发育早期应用BARseq2还可以洞察这些分子“实际上是如何指导这些投射的建立的”。
将空间映射与基因表达联系起来的能力意味着科学家们现在可以开始解决一个长期存在的问题:拥有相同分子表达谱的神经元群是否具有相似的通信模式?换句话说,艾伦研究所(Allen Institute)所长Hongkui Zeng表示,研究人员能使用基因表达模式来预测神经细胞会向何处投射吗?
其他研究人员正在使用“条形码”病毒来回答不同的问题。例如,由马萨诸塞州波士顿哈佛医学院(Harvard Medical School)的神经免疫学家Francisco Quintana带领的研究人员,开发了一种名为RABID-seq(狂犬病“条形码”相互作用检测后测序)的方法,来研究体内细胞与细胞相互作用的机制。这项技术使用的病毒被设计成只感染感兴趣的细胞,并在细胞间传播时表达“条形码”。这有助于研究人员确定哪些细胞有相互作用,然后确定可能介导这些相互作用的分子途径。研究者们还改造了病毒,使其表达红色荧光蛋白mCherry,从而使他们能够在细胞分类器中分离出被感染的细胞,并在后续实验中研究其机制。Quintana表示,研究人员可以了解从“哪些细胞相互作用”到“哪些机制”及潜在靶标。
在艾伦研究所,Zeng等人创造了“增强病毒”来驱动特定细胞类型中目标基因的表达。研究人员使用单细胞RNA测序和一种称为单细胞ATAC-seq的技术来识别DNA片段,这些片段可与调节基因转录的蛋白质相互作用。然后,他们可以将相关的调控区域插入病毒中,以驱动特定基因在特定细胞类型中的表达。Zeng表示,这可以用在脑切片甚至其它物种中,包括通常不适合基因编辑的组织中。
纽约市哥伦比亚大学(Columbia University)的神经科学家Rui Costa计划使用“增强病毒”来梳理小鼠神经元在学习、奖励和运动对神经递质多巴胺做出反应的作用,并研究不同的退化易感性。这种“多巴胺能”神经元在帕金森病(Parkinson’s disease)等疾病中是缺失的。
光作用
其他科学家正在开发使用光遗传学(optogenetics)探测神经元活动的新颖方法,即利用光来控制细胞的技术。
通常,研究人员使用一种称为Cre重组酶(Cre recombinase)的酶来打开或关闭特定细胞类型中的基因,或对遗传或化学信号作出反应。2016年,两个独立的研究团队将Cre重组酶置于光的控制之下。在这两种情况下,都是将酶分成两部分,只有在蓝光下重新组装时才会变得活跃。然而,这意味着需要向组织注射两个单独的工程基因,并且这两种基因需要表达在相似的水平才能使该技术发挥作用。法国里昂高等师范学院(École Normale Supérieure de Lyon)的分子遗传学家Gaël Yvert表示,如果科研人员可以用单链蛋白质控制Cre,那么可能会更高效、更快速。
为了创建一个更强大的系统,Yvert的团队仔细研究了Cre的晶体结构,寻找酶的片段,以便他们利用光来控制蛋白质。Yvert表示,他们正在寻找“可以解锁或充当开关”的物质。他们确定了几个对酶活性至关重要的螺旋,并将来自燕麦植物的光响应结构域融合到这些位置。其结果是LiCre:一种可以在几分钟内被激活并达到比以前系统作用更大的酶。
达拉斯德克萨斯大学西南医学中心(University of Texas Southwestern Medical Center)的博士后研究员Steven Wyler希望使用LiCre研究称为神经节(ganglia)的神经元细胞体群,以便更多地了解关于来自各种组织的信息如何帮助大脑保持代谢稳定的信息。但神经节是脆弱的结构,很容易损坏。Wyler表示,LiCre有望让他们对Cre活动进行空间和时间上的控制,而不会对神经元造成物理损伤。
研究人员还创造了测量活细胞内动态钙流的传感器。钙水平对生物学决策至关重要。例如,它们可以决定肌肉细胞何时收缩或启动程序性细胞死亡(细胞凋亡),因此准确量化它们有助于科学家建立细胞行为模型。阿姆斯特丹大学(University of Amsterdam)的细胞生物学家Joachim Goedhart表示,大多数现有工具都可以确定钙水平是上升还是下降,但几乎不可能量化实际浓度。
这些技术通常使用能够在钙存在下发出荧光的蛋白质,但荧光水平也会受到实验条件的影响,例如pH、探针的量或样品的厚度。解决此类麻烦的一种方法是使用荧光寿命(荧光团在吸收光子后处于激发态的时间)而不是强度。
为了利用这一特性,Goedhart等人修改了绿松石荧光蛋白的结构以优化其寿命和亮度,并添加了一个钙敏感蛋白结构域。研究结果是研发了一种可以提供单个细胞和多细胞组织中钙水平的可靠测量探针。
阿姆斯特丹大学的神经科学家Helmut Kessels等人计划在小鼠大脑切片中使用该探针来测试细胞内钙水平是否随着年龄的增长或细胞和组织开始显示阿尔茨海默病的特征而下降。他迫切希望测量结果不会随样本厚度而改变。他表示,由于探针的信号是使用荧光寿命成像测量的,这应该与组织深度无关。
使用这种荧光标记的一个潜在限制是许多显微镜的速度。目前,Goedhart的显微镜系统最快只能以每1.6秒一次的速度进行测量,这可能会限制在神经科学中的某些应用,因为钙水平的波动与每秒200次左右的神经元放电频率相关。但速度更快的显微镜确实存在:一些实验室已经在那里建造了自己的显微镜,商业版本可以通过供应商获得,例如德国韦茨拉尔的Leica Microsystems和柏林的Picoquant。
用BRAseq2捕获小鼠大脑切片中的基因表达。
会聚信号
还有另一个更广泛的局限性。上个月在加州大学戴维斯分校(University of California, Davis)成立实验室的神经科学家Christina Kim提到,钙指示剂只能让研究人员“实时读出神经活动”。Kim表示,这是一个问题,因为如果科研人员想操纵神经元或深入研究它们的分子构成,他们需要能够确定哪些神经元与何种特定行为相关。
当Kim在加利福尼亚斯坦福大学(Stanford University)Alice Ting的化学生物学实验室工作时,她和博士后研究员Mateo Sanchez开发了一种可以做到这一点的方法。
该工具建立在Ting实验室创建的早期技术的基础之上,称为快速光和活性调节表达技术,或者称为FLARE(fast light- and activity-regulated expression)。与许多基因编码的传感器相同,FLARE结合钙和光传感来识别在确定的时间窗口内活跃的神经元群。但它更进一步:在检测到钙浓度升高和蓝光的存在时,它会导致膜中的一种蛋白质进入细胞核并开始驱动荧光报告蛋白的转录。这提供了哪些细胞处于活动状态的持续性记录,并使得可以随后对这些相同细胞进行其它特性分析。
但是,Ting表示,FLARE有“相当大的背景泄漏”,即使在没有光和钙的情况下也能发出信号。并且因为神经元至少需要暴露于其10分钟,这对于体内应用于神经细胞的快速行为检测来说太慢了。
Kim和Sanchez做了两个关键的改进。首先,他们使用一种更有效的酶来控制转录因子的转运,从而使信号更强。其次,他们优化了感光分子,以进一步减少泄漏量。
改进的工具称为快速光和钙调节表达,或FLiCRE(fast light- and calcium-regulated expression),可以标记被激活的神经元,时间短至一分钟。在去年12月发表的一篇论文中,Kim等人在小鼠身上使用了这种方法来标记和识别有助于调节厌恶行为的细胞,例如避免电击或令人不快的气味,然后刺激相关神经元,而不需要让小鼠实际受到不愉快的刺激。
更深刻的理解
尽管如此,虽然钙水平和其它细胞特性可以揭示神经回路,但神经科学中一些最深层次的问题需要其他方法。弗吉尼亚州阿什本霍华德休斯医学研究所(Howard Hughes Medical Institute’s Janelia Research Campus)Janelia研究园区的神经科学家Kaspar Podgorski表示,钙成像会告诉研究人员在特定情形中哪个神经元会被激活,但它不会告诉他们为什么会激活。了解是什么让给定的神经元激活需要测量进入该细胞的输入信号。
一套传感器现在正在帮助研究人员测量这些输入信号。例如,dLight1和GRABDA传感器检测多巴胺的变化。GACh系列传感器监测乙酰胆碱的传输(一种涉及扩张血管和减慢心率的关键神经递质)。红移多巴胺传感器(red-shifted dopamine sensors, RdLight1)可以与基于绿色荧光蛋白的传感器相结合,为科学家提供更细致入微的神经元系统视图。
Podgorski表示,神经元间的交流很有趣。神经元接收数以千计的输入信号。他们只是被“轰炸”了。不知何故,细胞将所有这些信号解析为有意义的效应,将它们转化为适当的动作。他还提到,神经计算是一个问题,信息如何通过网络流动?输入如何转化为输出?这些活动又去了哪里?Podgorski认为他们真的处于能够非常丰富地研究神经计算的尖端。
原文检索:
Esther Landhuis. (2021) Deep dives into neural circuits. Nature, 559: 335-337.
郭庭玥/编译