Delta毒株为何如此危险
计算机模拟的冠状病毒 SARS-CoV-2 结构。
科学家们正在解开SARS-CoV-2的生命周期,以及该病毒如何巧妙躲避免疫攻击的谜题。
冠状病毒表面包裹了一层糖衣。看着显示屏上计算机模拟的SARS-CoV-2刺突蛋白结构——新冠病毒表面突起的蛋白,Rommie Amaro忍不住感慨:这太惊人了。这些刺突蛋白都穿着一层聚糖组成的盔甲。
加州大学圣地亚哥分校(University of California, San Diego)的计算生物物理化学家Amaro指出,裹着这么多的聚糖,刺突蛋白就很难被细胞识别。
许多病毒都有聚糖覆盖它们的外部蛋白质,就像披着羊皮的狼一样,通过这种伪装,病毒能躲避免疫系统的探测。但去年,Amaro的实验室小组和合作者根据结构和基因数据,并通过超级计算机逐个原子地测绘了刺突蛋白的糖衣图谱。2020年3月22日,她将模拟图谱发布到Twitter上。一个小时内,一位研究人员在评论中问道:从蛋白质顶部伸出的裸露的、未包被的环形结构是什么?
Amaro也不知道答案。但十分钟后,德克萨斯大学(University of Texas)奥斯汀分校的结构生物学家 Jason McLellan 评论:未包被的环形区域是受体结合域 (Receptor binding domain, RBD),是病毒刺突蛋白与人体细胞受体结合的三个部分之一(图“隐藏的刺突蛋白”)。
在Amaro的模拟中,当RBD位于聚糖上方时,两个聚糖会迅速结合,并将RBD固定在该位置,就像自行车上的支架一样。当Amaro使计算机模型中的聚糖发生突变时,RBD失活了。McLellan的团队建立了验证该假说的实验室方法,到2020年6月,合作者报告称,使这两种聚糖发生突变会降低刺突蛋白与人类细胞受体结合的能力——McLellan指出,这种作用在冠状病毒中是被首次发现的。Amaro表示,剪掉这两种糖可能会降低病毒的传染性,尽管研究人员还没有办法做到这一点。
自COVID-19大流行开始以来,科学家们一直在详细了解SARS-CoV-2如何感染细胞。通过逐步解析感染过程,他们希望找到更好的、阻断其感染细胞的疗法和疫苗,并了解为什么最新的毒株,如Delta变种,更容易传播。
在数十年冠状病毒研究的支持下,科学家们通过19个月的工作,得到了SARS-CoV-2侵入人体细胞的详细解析(图“新冠病毒的生命周期”)。科学家们发现了关键的适应性,可以帮助病毒以惊人的强度抓住人体细胞,然后在进入人体细胞后将自己隐藏起来。后来,当病毒离开细胞时,SARS-CoV-2会执行一个关键的处理步骤,以增强感染力,从而感染更多细胞。这些机制使得新冠病毒能够如此迅速传播,并夺去数百万人生命。对此,伦敦帝国理工学院(Imperial College London)病毒学家Wendy Barclay表示,这就是为什么它如此难以控制的原因。
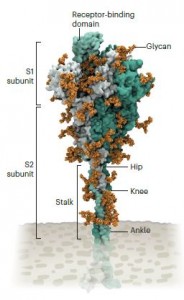
图 隐藏的刺突蛋白。新冠病毒的刺突蛋白被糖分子(聚糖)所包裹,因此能逃避免疫细胞的探测。糖分子可以连接在刺突蛋白主干的三个区域,增加灵活性。
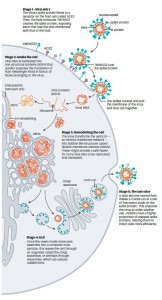
图 新冠病毒的生命周期。下图简单描述了SARS-CoV-2如何进入和离开细胞。
刺刀直入
感染始于刺突蛋白。每个 SARS-CoV-2病毒的外表面都布满了24-40个随意排列的刺突蛋白,这是其与人类细胞融合的关键。对于其它类型的病毒,例如流感,外部融合蛋白相对刚性,灵活度较小。然而,根据德国法兰克福马克斯普朗克生物物理研究所(Max Planck Institute of Biophysics)的生物化学家 Martin Beck 等人于2020年8月发表的工作,SARS-CoV-2的刺突蛋白非常灵活,并且可以在三个点上与人类细胞结合。
新冠病毒的刺突蛋白能够四处摆动、摇摆和旋转,这可以使它们更容易扫描细胞表面,并使多个刺突蛋白与人体细胞结合。Beck指出,其它冠状病毒没有类似的实验数据,但由于刺突蛋白序列在进化上高度保守,因此可以合理地假设该特征是共享的。
在大流行早期,研究人员证实 SARS-CoV-2刺突蛋白的RBD能与细胞上的ACE2受体结合,该受体主要表达于人体喉咙和肺细胞表面上。该受体也是非典病毒(SARS-CoV)感染细胞的关键。但与 SARS-CoV 相比,SARS-CoV-2与ACE2的结合强度估计是SARS-CoV的 2-4 倍,因为 RBD 的一些突变使其与ACE2的结合更稳定。
令人担忧的 SARS-CoV-2变体往往在刺突蛋白的S1亚基中发生突变,该区域有RBD,并负责与ACE2受体结合(S2亚基促使病毒与宿主细胞膜融合。)
例如,Alpha变体在刺突蛋白序列中包含10个突变,这导致RBD更有可能停留在“向上”的构象(这个构象使RBD更容易与细胞表面的ACE2受体结合)。北卡罗来纳州达勒姆杜克人类疫苗研究所(Duke Human Vaccine Institute)的结构生物学家、正在研究刺突蛋白的Priyamvada Acharya指出,这些变体通过让病毒更容易进入细胞来帮助病毒传播。
现在正在世界各地传播的Delta变体在S1亚基中包含多个突变,其中三个存在于RBD中,似乎提高了RBD与ACE2的结合能力,并增强了病毒逃避免疫系统的能力。
膜融合
一旦病毒的刺突蛋白与ACE2结合,宿主细胞表面的其它蛋白质就会启动一个过程,导致病毒和细胞膜融合(图“病毒进入细胞”)。
非典病毒使用两种宿主蛋白酶中的一种侵入:TMPRSS2(发音为“temppress two”)或组织蛋白酶L。TMPRSS2是进入的更快途径,但SARS-CoV通常通过内体——脂质包裹的小泡——进入,这种途径依赖于组织蛋白酶L。然而,当病毒颗粒通过这种途径进入细胞时,抗病毒蛋白可以捕获它们。
SARS-CoV-2与SARS-CoV不同,因为它有效地使用了TMPRSS2,这是一种在呼吸细胞表面高度表达的酶。首先,TMPRSS2在刺突蛋白S2亚基上切割一个位点。切口暴露了病毒上一系列疏水性氨基酸,这些氨基酸迅速将自己嵌入到最近的膜中——宿主细胞的膜。接下来,长长的刺突像拉链一样将病毒和细胞拽到一起,迫使病毒和细胞膜融合。
然后病毒将其基因组直接注入细胞中。根据Barclay等人4月发表的工作,SARS-CoV-2以这种弹簧方式入侵,比SARS-CoV感染得更快,并避免了可能被困在内体中的问题。
该病毒使用TMPRSS2快速进入解释了为什么尽管实验室的早期研究有希望,但疟疾药物氯喹在临床试验中对COVID-19疗效不佳。氯喹针对的是完全依赖组织蛋白酶进入内体的病毒。Barclay提醒,当新冠病毒在人体呼吸道中传播和复制时,它不依靠内体,因此氯喹这种内体破坏药物就是无效的。
这一发现还指出蛋白酶抑制剂是一种很有前景的治疗选择,可以防止病毒使用 TMPRSS2、组织蛋白酶 L 或其它蛋白酶进入宿主细胞。一种在日本被批准用于治疗胰腺炎的 TMPRSS2抑制剂甲磺酸卡莫司他阻止了病毒进入肺细胞,但该药物在初始临床试验中并未改善患者的预后。
哥廷根德国灵长类动物中心感染生物学部(Infection Biology Unit at the German Primate Center)主任、领导了ACE2结合和TMPRSS2通路的研究的Stefan Pöhlmann指出,从他的角度来看,我们应该在一开始就拥有广泛的抗病毒药物,类似于这样的蛋白酶抑制剂,来对抗新的疾病爆发和预防未来的大流行。
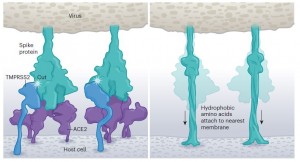
图 病毒进入细胞。在TMPRSS2酶切割SARS-CoV-2刺突蛋白后,病毒和宿主细胞膜融合。这暴露了刺突蛋白中的疏水性氨基酸,这些氨基酸迅速嵌入最近的膜——宿主细胞的膜。
致命的竞争
感染的下一步就没那么清晰了。盐湖城犹他大学(University of Utah)的化学家 Janet Iwasa 表示,一旦病毒进入细胞,就会有更多的黑盒子,有更多的不确定性和相互竞争的假设。她正在开发一种病毒生命周期的动画模拟。
在病毒将其RNA基因组射入细胞后,细胞质中的核糖体将病毒RNA的两段翻译成长串氨基酸,然后将其剪断成16种蛋白质,其中包括许多参与RNA合成的蛋白质。后来,产生了更多的RNA。这些RNA编码总共26种已知的病毒蛋白,包括用于制造新病毒颗粒的结构蛋白,例如刺突和其它辅助蛋白。通过这种方式,病毒开始大量复制其自身的信使RNA。但它需要细胞机器来将这些mRNA翻译成蛋白质。
冠状病毒以多种方式接管了细胞的RNA翻译机器。以色列雷霍沃特魏茨曼科学研究所(Weizmann Institute of Science in Rehovot)的病毒学家 Noam Stern-Ginossar等人深入研究了SARS-CoV-2抑制宿主mRNA翻译以支持自身RNA翻译的三种机制。 Stern-Ginossar 指出,没有一种机制是这种病毒独有的,但只有新冠病毒是3种机制都有,且其速度之快、功能之强是前所未有的。
首先,病毒消除了竞争:病毒蛋白Nsp1是病毒到达细胞时首先翻译的蛋白之一,它会招募宿主蛋白来系统地清除所有没有病毒标签的细胞mRNA。当Stern-Ginossar的团队将相同的标签放在宿主mRNA的末端时,该mRNA没有被清除。
其次,感染使细胞中的整体蛋白质翻译减少了70%。根据两个研究小组的工作,Nsp1再次成为罪魁祸首,其能够物理性地阻断核糖体的进入通道,因此mRNA无法进入核糖体。 Stern-Ginossar指出,细胞剩余的少量翻译能力只用于翻译病毒RNA。
最后,病毒会关闭细胞的警报系统。这以多种方式发生,但Stern-Ginossar的团队确定了 SARS-CoV-2的一个明确机制:病毒阻止细胞mRNA脱离细胞核,包括用于提醒免疫系统感染的蛋白质指令。第二个团队证实了这一发现,并再次指出Nsp1:该蛋白质似乎堵塞了细胞核中的出口通道,因此没有任何东西可以从细胞核离开。
因为基因转录物不能离开细胞核,受感染的细胞不会释放很多干扰素——这些是信号蛋白,可以提醒免疫系统注意病毒的存在。SARS-Cov-2 在关闭该警报系统方面特别有效:与其他呼吸道病毒(包括SARS-CoV和呼吸道合胞病毒)相比,SARS-CoV-2感染诱导的干扰素水平显著降低。今年6月,研究人员报告了Alpha变体的突变,这似乎使其能够更有效地抑制干扰素的产生。
Stern-Ginossar指出,很明显,SARS-CoV-2是一种感染速度非常快的病毒,它具有独特的能力,可以防止我们的免疫系统在第一阶段识别和对抗感染。当免疫系统确实意识到存在病毒时,病毒已经太多了,以至于免疫反应蛋白有时会以比正常情况更快的速度涌入血液——这可能会造成损害。医生在大流行初期就发现,一些重症COVID-19患者会受到对 SARS-CoV-2过度活跃的免疫反应和病毒的双重伤害。一些有效的治疗方法的作用机制就是抑制这种免疫反应。
细胞重塑
一旦病毒接管了细胞的翻译机器,它就会开始对细胞进行管控,根据其需求对细胞进行从里到外的改造。
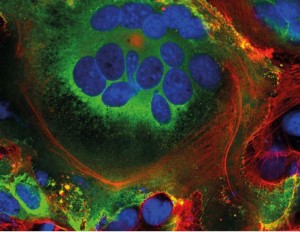
首先,一些新制造的病毒刺突蛋白移动到细胞表面,并从宿主细胞膜中伸出。在那里,它们激活宿主钙离子通道,将脂质层排出细胞外部。此时,受感染的细胞与表达ACE2的邻近细胞融合,形成大量含有多达20个细胞核的呼吸细胞。
伦敦国王学院(King’s College London)的分子生物学家 Mauro Giacca 领导的团队于4 月 18日发表了这一发现。他指出,这些被名为合胞体的融合结构一般由HIV和单纯疱疹病毒等病毒感染引起,而不是由SARS病毒引起。他假设合胞体的形成使受感染的细胞能够存活更长时间,产生越来越多的病毒颗粒。新冠病毒不是那种“干一票”就走的病毒,它会在感染细胞里待很久。由北京中国医学科学院孙强研究员领导的第二个团队发现,一些感染了 COVID-19的细胞甚至与淋巴细胞(人体自身的免疫细胞之一)形成合胞体。这是已知的肿瘤细胞逃避免疫的机制,但此前从未有研究报道过病毒也存在这种机制。这表明受感染的细胞通过简单地抓住,并与附近的免疫侦察兵合并来避免免疫检测。
在细胞内部,更多的变化正在发生。与其它冠状病毒一样,SARS-CoV-2将细长的内质网(endoplasmic reticulum,一种参与蛋白质合成和运输的扁平膜网络)转化为双膜囊泡,就像ER正在吹泡泡一样。这些双膜囊泡(double-membrane vesicles,DMVs)可能为病毒RNA 的复制和翻译提供了一个安全的场所,使其免受细胞中先天免疫传感器的影响,但该假设仍在研究中。
参与制造 DMV的蛋白质可能是很好的药物靶点,因为它们似乎是病毒复制所必需的。例如,病毒需要宿主蛋白TMEM41B来动员胆固醇和其它脂质以扩展ER膜,以便所有病毒mRNA都能成功翻译。参与这项研究的加尔维斯顿德克萨斯大学医学分部(University of Texas Medical Branch)的冠状病毒研究员 Vineet Menachery表示,如果你敲除TMEM41B,就会对感染产生重大影响。冠状病毒跨膜蛋白Nsp3也可能是一个目标:它在DMV的壁上形成一个冠状孔,以释放新制造的病毒RNA。
大多数具有包膜的病毒通过直接在细胞边缘组装病毒颗粒,并选择细胞的质膜作为释放点。但是新制造的冠状病毒蛋白选择了另一种方式。
多年来,有证据表明冠状病毒是通过高尔基体复合体运输出细胞的。高尔基体是一种像邮局一样工作的细胞器,将分子包装在膜中并将它们发送到细胞的其它部分。在那里,病毒从高尔基复合体的膜上形成一个脂质包膜;马里兰州巴尔的摩约翰霍普金斯大学(Johns Hopkins University)病毒学家和细胞生物学家 Carolyn Machamer对冠状病毒进行了30年的研究。
但在去年12月,位于马里兰州贝塞斯达的美国国家心肺血液研究所(US National Heart, Lung, and Blood Institute)的细胞生物学家 Nihal Altan-Bonnet 等人报告,他们检测到冠状病毒通过溶酶体——内部充满降解细胞成分的酶的细胞垃圾箱——离开细胞。Altan-Bonnet 指出,阻断基于高尔基体的分泌途径似乎不会影响释放的传染性病毒的数量。她的团队的证据表明,病毒蛋白通过进入内质网形成包膜,然后接管溶酶体离开细胞。研究人员目前正在测试阻断溶酶体退出过程的抑制剂作为潜在的抗病毒候选药物。
与从质膜中出芽相比,让细胞通过高尔基体或溶酶体是缓慢且低效的,因此科学家们不知道 SARS-CoV-2为什么会这样做。Machamer怀疑高尔基体或溶酶体衍生的包膜的脂质成分比质膜的脂质成分对病毒更有益。她表示,如果我们更好地理解这一部分,那么新型抗病毒疗法成功的概率就会高很多。
在表达SARS-CoV-2刺突蛋白(绿色)的细胞中看到的融合细胞结构(合胞体)。细胞核为蓝色,细胞骨架为红色。
最后一刀
在离开细胞的过程中,还有一个事件使这种病毒极具传染性:在5个氨基酸的位点进行快速剪切,使病毒能快速攻击下一步目标细胞。
其它冠状病毒在刺突的S1和S2亚基的连接处具有单个精氨酸氨基酸,而SARS-CoV-2的该区域具有5个氨基酸形成的链:脯氨酸、精氨酸、精氨酸、丙氨酸和精氨酸。Pöhlmann表示,因为这显得非常不寻常,他们一直关注这个区域。结果证明,是的,该部位对于肺细胞的侵袭至关重要。2020年5月,Pöhlmann等人报告,一种名为弗林蛋白酶的宿主细胞蛋白识别并剪断了那串氨基酸——这种剪断对于病毒有效地进入人类肺细胞是“必不可少的”。
这并不是研究人员第一次在病毒上发现弗林蛋白酶裂解位点。Barclay指出,高致病性禽流感病毒也有弗林蛋白酶切位点。当一位同事将SARS-CoV-2培养物中的一种自发失去弗林蛋白酶裂解位点的菌株送给Barclay时,她的团队发现,与感染大流行菌株的雪貂相比,感染该菌株的雪貂释放的病毒颗粒量较少,并且感染附近其它动物的概率降低。Barclay的团队于2020年9月的预印本中报告这一结果,与此同时,荷兰的一项研究还发现,具有完整弗林蛋白酶裂解位点的冠状病毒比没有它的冠状病毒进入人体气道细胞的速度更快。
科学家们怀疑,弗林蛋白可能在病毒体组装过程中的某个时间点或在释放之前切割了该位点。伊利诺伊州芝加哥洛约拉大学(Loyola University Chicago)的病毒学家Tom Gallagher指出,切割发生的时间点可能解释了为什么病毒通过高尔基体或溶酶体排出。病毒一旦组装好,就会进入高尔基体或溶酶体,这些细胞器内存在大量的弗林蛋白。
Gallagher指出,通过剪断S1和S2亚基之间的键,弗林蛋白酶的剪切松开了病毒颗粒的刺突蛋白,因此在细胞进入过程中,刺突蛋白能对TMPRSS2的第二次切割做出反应,从而暴露出能快速与宿主细胞膜融合的疏水区域。如果刺突蛋白没有被弗林蛋白酶预先剪切——它们并不总是如此——它们会绕过TMPRSS2,并通过较慢的内体途径进入,如果有的话。
两种冠状病毒变种Alpha和Delta改变了弗林蛋白酶的裂解位点。在Alpha变体中,初始脯氨酸氨基酸变为组氨酸 (P681H);在Delta变体中,它变为精氨酸 (P681R)。 Barclay指出,这两种变化都会使序列的酸性降低,并且氨基酸链越是呈碱性,弗林蛋白酶识别和切割它的效率就越高。他们认为,这是Delta变体传染力加强的原因。
更多的弗林蛋白酶切割意味着更多的刺突蛋白能更快地进入人体细胞。Menachery指出,在 SARS-CoV中,只有不到10%的刺突蛋白被预先剪切,他的实验室小组一直在量化预先剪切的刺突蛋白,但尚未发表这项工作。在SARS-CoV-2中,这个百分比上升到50%。在Alpha 变体中,它超过50%。该小组发现,在高度传播的Delta变体中,超过75%的刺突蛋白经过预先剪切,能更有效地感染人类细胞。
已知的未知数
科学界对SARS-CoV-2的理解仍处于皮毛。关键的未知数包括与每个刺突蛋白结合所需的 ACE2受体的数量;S2位点被TMPRSS2切割的具体阶段;以及病毒-细胞膜融合所需的刺突蛋白数量,McLellan认为这些都只是基础。2020年4月,加利福尼亚大学旧金山分校(University of California, San Francisco)的一个团队确定了SARS-CoV-2与人类蛋白质之间至少有332种相互作用。
跟上快速变异的病毒的步伐并不容易。专家们一致认为,迄今为止,大多数突变都与病毒传播的效率有关,而不是病毒对宿主的破坏程度。本月,一项研究报告称,与早期版本的病毒相比,Delta变体在人们肺部和喉咙内的生长速度更快,水平更高。
Stern-Ginossar表示,尚不确定Delta的突变是增强病毒感染性的。这是许多实验室试图弄清楚的事情。
原文检索:
Megan Scudellari. (2021) How the coronavirus infects cells — and why Delta is so dangerous. Nature. 595: 640-644.
张洁/编译