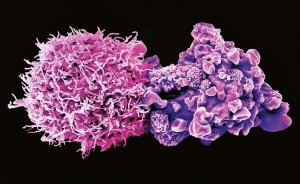
追踪癌症干细胞的起源
病人的胶质母细胞瘤的小碎片可以用来构建类器官模型,用于研究癌症干细胞在疾病中的作用。
研究癌症干细胞如何分裂和扩散有助于解释肿瘤是如何生长和逃避治疗的。
Arnold Kriegstein等人观察到,癌细胞在培养皿中快速移动,有时在分裂前的一个小时内,它们能移动的距离达到自身长度的30倍。一般来说,在胎儿大脑发育过程中,只有特定的胚胎干细胞能移动这么快。但是这些癌细胞来自胶质母细胞瘤,这是一种特别难以治疗的脑肿瘤,部分原因是其扩散速度非常快。
加州大学旧金山分校(University of California, San Francisco, UCSF)的发育神经生物学家Kriegstein指出,这种行为暗示了癌细胞和干细胞之间的相似之处,而干细胞在胚胎发育中非常重要。因此,重新激活通常为胚胎发育保留的基因表达程序,往往是一个细胞发展成癌细胞的一部分。Kriegstein想深入研究这种联系。
Kriegstein的团队与UCSF放射肿瘤学家David Raleigh合作,将胶质母细胞瘤样本分成了两部分:一部分富含快速移动的干细胞样细胞,另一部分含有分化成更成熟癌细胞类型的细胞。研究人员在人脑类器官(模仿器官的简化结构)中分别培养这两部分细胞,预想的是只有类似干细胞的癌细胞才能重建肿瘤。但令他们惊讶的是,这两部分细胞都形成了大量异质的肿瘤细胞(既包括能快速移动的干细胞样细胞,也包含分化成成熟癌细胞的细胞)。Kriegstein表示,最开始每部分细胞都主要由一类细胞构成,但最终都发展成了具有很大的异质性的肿瘤组织。这是怎么发生的呢?我们对此一无所知。
自20世纪90年代以来,研究人员一直怀疑癌症中的干细胞是疾病复发、癌症扩散(或转移)和治疗耐药性的关键。但是癌症干细胞似乎不符合干细胞的特征。它们没有明确的分子标记,可能并不是每个肿瘤内都有这样的干细胞;而且,也许最令人沮丧的是,它与疾病的侵袭性或治疗结果几乎没有关联。
阿姆斯特丹大学医学中心(Amsterdam University Medical Centers)的干细胞研究员Louis Vermeulen提醒,在某些癌症中,几乎所有的细胞都具有干细胞的功能;而在另一些研究中,干细胞和分化程度更高的肿瘤细胞有着清晰的层次结构。真正的争论是:在特定的癌症中有多少干细胞?它们一直是干细胞,还是由其它细胞转变而来的?
为了回答这些问题,癌症生物学家正在拓宽他们的工具箱。除了改进的培养方法,比如Kriegstein团队使用的类器官,研究人员还在开发发育生物学的方法。一种是谱系追踪,它通常用于追踪胚胎细胞如何生长和分化成成体组织。但它也可以揭示单个癌细胞如何重建其母体肿瘤中的遗传多样性。现在,癌症生物学家正在将这种方法与单细胞方法相结合,以更清楚地了解癌症干细胞是否以及如何引发疾病的。
增加培养模型
Kriegstein和Raleigh之所以决定使用类器官,是因为缺乏良好的动物模型:例如,胶质母细胞瘤很难在小鼠和大鼠身上培养。但是类器官也可以比啮齿类动物更接近人类组织环境。Kriegstein团队的前博士后研究员Aparna Bhaduri指出,类器官极其好用。在显微镜下,研究人员只是用吸管将肿瘤细胞吸到类器官表面,然后等待大约45分钟,肿瘤就形成了。这比动物实验简单多了。
尽管如此,类器官仍然不能取代动物,特别是因为这些结构缺乏血管,所以不能捕捉肿瘤与循环系统的相互作用。Bhaduri现在在加州大学洛杉矶分校(University of California, Los Angeles)领导自己的干细胞生物学实验室。她表示,她们可能还需要进行更多的优化,以确保她们能捕获一个特定肿瘤中可能存在的所有异质性。
宾夕法尼亚州匹兹堡大学医学中心(University of Pittsburgh Medical Center)的神经肿瘤学家Jeremy Rich表示,更复杂的是,类器官的营养和生长需求与常规培养的细胞不同,这使得它们难以用于高通量研究。他的团队使用生物打印——一种类似于3D打印的过程,使用细胞和培养基代替惰性材料——来研究炎症和免疫系统如何影响胶质母细胞瘤细胞的行为。免疫功能障碍是许多癌症的关键组成部分,但很难在类器官和动物模型中进行研究:前者没有免疫系统,后者已被设计成免疫功能受损,从而使人类肿瘤细胞可以在其中生长。
Rich等人使用不同细胞类型和前体材料(如透明质酸)的混合物来打印水凝胶。打印出来后,水凝胶生长介质会形成一个3D支架,里面有可以用作肿瘤模型的细胞。当Rich和他的团队尝试使用胶质母细胞瘤干细胞与其它神经细胞的不同组合混合的方法时,他们发现,在被称为巨噬细胞的免疫细胞存在的情况下,肿瘤细胞表达了一些与胶质母细胞瘤患者更强的侵袭性和耐药性相关的基因。他们还发现,在其它细胞类型的环境中生长的干细胞更接近于它们在现实世界中的行为,这表明组织环境在定义干细胞方面起到了一定的作用。
同样,巴黎居里研究所(Curie Institute)的细胞生物学家Silvia Fre也发现,在小鼠身上,健康的成体乳腺组织只含有不能形成肿瘤的分化干细胞。但是,如果将这些相同的细胞从组织中取出,它们会迅速重新激活多能性,重新拥有分化为离散细胞类型(包括癌变细胞)的能力,这进一步证实了组织环境在肿瘤发展中的关键作用。
更简单的培养模式也具有启发性。在2018年的一项研究中,Vermeulen等人使用了一种简单的模型系统(称为球体培养),肿瘤细胞在培养皿或在肿瘤异体移植物中自由漂浮的3D球体中生长。这些方法显示,人类结肠癌细胞越接近肿瘤的边缘,就越像干细胞。当研究小组从肿瘤中心取出不增殖的细胞并将其移植到肿瘤边缘时,这些细胞也开始表达增殖相关的分子标记。作者得出结论,人类结肠癌干细胞不是由其固有的基因表达模式决定的,而是由它们的位置决定的。Vermeulen指出,当他得知肿瘤环境是决定干细胞的主要因素时,他感到非常惊讶。随着细胞在肿瘤中位置的变化,其行为也跟着变化。
捕捉移动轨迹
这种环境和细胞特性的相互作用意味着癌细胞可能在某些实验条件下看起来像干细胞,但在其他条件下却不是,或者可能根据它们的“邻居”表达不同的基因集。它们也缺乏通用的表面标记,这使得标记和研究它们变得更加困难。但研究人员已经设计了一系列替代策略来跟踪细胞的轨迹,其中许多都借鉴了发育生物学工具集。
为了研究胚胎乳腺中的干细胞,Fre等人使用了一种名为Confetti的小鼠,之所以这样命名是因为该小鼠体内的细胞可以表达四种不同的荧光报告基因。当研究人员用一种化学物质处理动物,以诱导在发育过程中的不同时间报告蛋白的表达时,这些蛋白在不同的位置被激活。利用荧光显微镜,研究小组可以看到不同谱系的细胞最终在成体组织中的位置。Vermeulen等人在细胞培养研究中使用了类似的基于荧光的方法来了解环境如何控制结肠癌干细胞。
当细胞发生突变并分化成不同的亚群时,遗传条形码是追踪细胞的另一种选择。该方法给每个细胞群体一个固定的遗传条形码,随着细胞的分化,条形码也在进化。通过对群体中的所有条形码进行测序并进行比较,研究人员就可以弄清楚不同细胞之间是如何相互关联的,以及它们对肿瘤生长的相对作用。
这种方法的早期变体依赖于慢病毒内部携带的静态条形码,这是一种将序列随机插入细胞池的方法。现在,基因编辑工具CRISPR正在改进这一过程。
在基于CRISPR的谱系追踪中,研究人员将一系列CRISPR目标序列插入到细胞的基因组中。然后,Cas9酶会周期性地切割这些目标,触发DNA修复过程,并留下一个遗传伤疤,作为一个细胞及其后代的唯一标识符。与慢病毒条形码不同的是,这种系统动态地产生独特的条形码,可能是每次细胞分裂时产生的,这使研究人员能够重建不同细胞及其后代之间的关联。荷兰乌得勒支Hubrecht研究所(Hubrecht Institute)的干细胞生物学家Alexander van Oudenaarden表示,变化是随着时间积累的。这与之前使用的慢病毒条形码有本质的不同。
另一种方法是将荧光蛋白的序列与重复的DNA片段——长段重复的胞嘧啶和腺嘌呤碱基,细胞认为这些序列是有问题的——连接起来。细胞分裂时,它们会定期“修复”这个重复的序列,通过修剪它,最终将荧光蛋白的序列带到基因组中可以表达的位置。Vermeulen表示,这种修复在大约每10,000个细胞中发生一次,会发出微小的荧光信号,从而被显微镜捕获。这种荧光标记的优点是不需要化学物质来激活的。这是一种完全不触及细胞的谱系追踪方法。
这些策略各有利弊。一些CRISPR序列比其它的更容易留下疤痕,这就好比将漏洞引入一个理论上无漏洞的过程。显微技术和基于测序的策略都需要高级的计算和技术技能。然而,与单细胞RNA测序相结合,这些标签提供了强大的工具来评估肿瘤中单个细胞的相对重要性。
Vermeulen指出,如果肿瘤是由癌症干细胞驱动的,那么只有少数有标记的细胞会增殖并成为大型克隆。但在依赖多种细胞类型的肿瘤中,大多数细胞会扩增。当这些数据被放入一个数学模型中,你就可以确定其中一种增长模式对另一种增长模式的影响程度。
算法挑战
这种模型可以提供肿瘤细胞生长和变化的更完整的图像。但它们也需要新的计算算法。传统的用来推断细胞间系统发育关系的模型不能处理血统追踪数据集与单细胞RNA测序数据集结合时产生的大量信息。
西雅图华盛顿大学(University of Washington)的遗传学家Jay Shendure表示,这是发育生物学家长期以来一直在努力解决的问题。他的团队开发了第一批CRISPR系统,用于同时进行谱系追踪和RNA测序。
当涉及到癌症研究中的谱系追踪时,最大的问题是技术:获得足够数量的条形码数据和处理丢失的数据。谱系追踪研究经常存在空白,因为一些细胞种群消失了,或者样本中的条形码序列数量太少,无法处理。Shendure认为,算法很难处理这些空白,所以最大限度地提高编码条形码的RNA序列的产量和稳定性至关重要。回收率一定要高。如果你在一个方案中使用了X个细胞,那么你会希望大部分细胞的信息都能被跟踪到。
在今年发表的一项研究中,加州大学旧金山分校的癌症研究人员Trever Bivona等人同时追踪了移植到动物体内的肺癌细胞的谱系和RNA表达的变化。基于Cas9的工具使他们能够实时跟踪基因变化如何驱使癌细胞在远处组织中扩散——肿瘤转移的过程。
该研究小组从动物体内6个不同位置捕获了超过40000个小鼠细胞的谱系和基因表达数据,发现细胞在不同的遗传状态之间来回变化了好几次,然后才形成了一个明显的、分化的路径。
为了分析这些大量的数据,Bivona的合作者——马萨诸塞州剑桥市怀特海德研究所(Whitehead Institute)的生物学家Jonathan Weissman和加州大学伯克利分校的计算机科学家Nir Yosef——开发了一套叫做Cassiopeia的工具,它有助于在CRISPR-Cas9条形码数据的基础上重建细胞谱系关系。Biyona和其他研究者已经将他们的分析工具免费提供给其他研究人员(go.nature.com/2ptezwd)。
就Bhaduri而言,她经常使用一个名为Seurat的工具集,这是统计学家Rahul Satija和计算生物学家Aviv Regev在哈佛-麻省理工学院博德研究所(Broad Institute of Harvard and MIT)时开发的。Seurat工具能够同时分析基因表达的变化和单个细胞中特定基因拷贝数的变化。
无论研究人员选择什么工具集,Bhaduri建议那些刚接触这类分析的人依靠教程,并结合算法开发人员提供的课程来开展工作。那些已经开发出自己内部分析软件的人,比如Vermeulen等人,通常会与生物统计学家合作来完成相关工作。
Shendure指出,尽管如此,该领域仍需要更好的工具。他指出,随着系统发育树中细胞数量的增长,可能排列方式的数量也会呈指数级增长。我们需要更丰富的工具,才能充分认识到这条探索路线的潜力。
依旧复杂
用发育生物学的视角来研究癌症干细胞问题,已经开始揭示了许多驱动癌症的复杂力量,以及细胞形成肿瘤的过多途径。Rich指出,通过干细胞这一棱镜来观察癌症确实改变了人们理解癌症的能力。
该领域仍然缺乏对癌症干细胞的精确定义,但这样的明确定义可能是不必要的。认识到肿瘤干细胞样特性的重要性,以及细胞微环境如何促使它们获得这些特性,可能足以引领新的治疗方法。
一些特征是癌细胞和胚胎组织的特征,如胶质母细胞瘤干细胞的快速移动行为或乳腺癌干细胞的多能性。在健康的成体组织中缺乏这些特性,这可能使它们成为理想的药物靶点,因为阻断癌细胞这些行为的疗法应该不会伤害正常细胞。而阻断这些行为——无论这些行为是否由可被定义为癌症干细胞的细胞表现出来——是这些研究努力的最终目标。
Rich提醒,到目前为止,我们还没有在治疗方面取得很大的成功。我们并没有证据证明,如果我们针对癌症干细胞,病人存活率就能提高。这一块研究领域目前还是空白。
原文检索:
Jyoti Madhusoodanan. (2021) Elusive cancer cells dissected using developmental-biology toolkit. Nature, 592: 647-649.
张洁/编译