基因疗法有望治愈大脑疾病

图为Evie Lewis和她的父母Elliot和Janell。Evie每隔几个月接受一次基因治疗,用于治疗脊髓性肌萎缩症。
一类可以抑制缺陷基因影响的药物可能有助于治疗大脑疾病,但一项临床试验的停止为这一领域敲响了警钟。
Susan第一次怀疑母亲可能出了什么问题时还是个孩子。当妈妈在上菜或洗碗的时候,经常会不小心摔坏杯子或盘子。Susan指出,妈妈会埋怨自己说‘笨手笨脚的’,但并不是这样的。妈妈的手脚非常灵活,我现在才意识到这些都是早期亨廷顿舞蹈病的征兆。
亨廷顿舞蹈病(Huntington’s disease, HD)是一种遗传性疾病,会导致大脑大面积退化,思维、行为、情绪和运动紊乱。这种疾病通常开始于中年,症状不明显,如情绪波动和难以集中注意力。随着病情的发展,人们会变得痴呆,失去语言或行动能力。
为了保护自己的隐私,Susan要求匿名。她清楚地记得得知母亲得了这种病的那天。那是1982年的春天,她的母亲因极度疲劳、经常摔倒和行动不规律而住进了医院。当时还没有针对这种情况的基因检测,所以她接受了一系列评估。她的神经科医生把全家人聚集在一个房间里告诉她这个消息。医生表示,Susan母亲患有亨廷顿舞蹈病,并指出目前没有有效的治疗方法,时这种疾病可能会遗传给后代。
这些直言不讳的话对Susan和她的兄弟姐妹的生活产生了深远的影响:她的哥哥决定永远不结婚,她的妹妹选择了绝育。然而,对Susan来说,这些选择都不可选:当她收到这个消息时,她已经怀孕了。
Susan觉得,她和丈夫“无法决定怎么做才是对的”。如果他们有了孩子,那么孩子长大后也会面临同样的选择。这太残忍了。最终,这对夫妇做出了令人心碎的选择——终止妊娠。
与亨廷顿氏症有关的基因叫做HTT,它编码一种叫做亨廷顿的蛋白质。致病的突变型HTT的第一个外显子中存在 CAG 三核苷酸的异常重复扩增。不像一些遗传疾病,个体只有携带两个拷贝的缺陷基因时,才会发生疾病。对于HD,个体只要携带一个突变型的HTT,就会罹患HD,并且有50%的概率遗传给下一代。Susan的母亲去世多年后,三个兄弟姐妹发现他们都遗传了这种疾病。
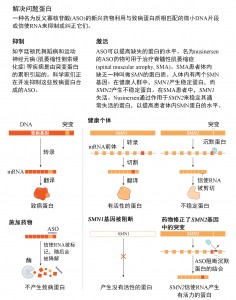
虽然自1993年以来,亨廷顿舞蹈症的遗传原因已经很清楚,但目前还没有治疗方法可以阻止或减缓该病的发展。其他大多数神经退行性疾病也缺乏有效的治疗方法,尽管它们的遗传根源不像亨廷顿舞蹈症那样明确,但与运动神经元疾病(肌萎缩性侧索硬化症,ALS)、阿尔茨海默病和帕金森病等疾病相关的许多基因几十年前就已被发现。现在,治疗这类疾病的潮流可能正在转变。许多研究人员对名为反义寡核苷酸(antisense oligonucleotide, ASO)的药物寄予厚望。它们是DNA或RNA对应的反义核酸序列,会与突变基因的特定RNA序列结合,并重新调节目标基因产生的蛋白质水平——提高缺失的蛋白质的表达或清除有缺陷的蛋白质(图“解决问题蛋白”)。
2016年,美国食品和药物管理局(Food and Drug Administration, FDA)批准了首个用于神经疾病的ASO药物,此后该领域呈爆炸式增长。这个领域已经从过去20年里的少量临床试验发展到目前正在进行的十几项针对各种神经退行性疾病的临床试验,其中一些已经进入了最后阶段。
其他ASO研究人员正在超越单一突变定义的疾病,着眼于具有更复杂遗传基础的疾病。这一最新进展使该领域的许多人对这项技术的未来感到乐观。加州大学圣地亚哥分校(University of California, San Diego, UCSD)的神经科学家Don Cleveland是首批研究ASO在神经系统疾病中的应用的科学家之一,他认为这只是一个开始,ASO在未来会有更多的应用。
但该领域的进展并非完全顺利。上个月底,一项大型3期临床试验突然中止,原因是该药对患者的益处并没有超过风险。由于ASO在许多情况下的疗效尚不清楚,而且通常是通过脊柱注射,因此一些研究人员长期以来一直在敦促对ASO保持谨慎。
尽管这项试验的结果令人失望,但Chris Boshoff不认为这是令人绝望的理由。他是马里兰州贝塞斯达的美国国家神经疾病和中风研究所(US National Institute of Neurological Disorders and Stroke)的一名科学项目经理,负责跟踪遗传疗法。Boshoff觉得,我们仍然有理由对这种模式能够实现的疗效持积极和热情的态度。
一种罕见疾病的突破
2011年,Elliot和Janell Lewis的第一个孩子Blakely出生时就患有一种罕见的遗传性神经退行性疾病——脊髓性肌肉萎缩症(spinal muscle atrophy, SMA)。患有SMA的人携带一种突变的SMN1基因,这种基因负责产生一种叫做生存运动神经元(SMN)的蛋白质。缺乏SMN会阻碍大脑与身体的有效沟通,导致肌肉无力和消瘦,并随着时间的推移而恶化。SMA有四种类型:最常见的形式是SMA1,也是最严重的。患有SMA1的人通常在出生后不久就会出现症状,大部分患者活不过两岁。
Blakely在三个月大的时候被确诊。Elliot 表示这几乎让他们崩溃了。当时,没有有效的疗法,Blakely在21个月大时去世。
2017年春天,这对夫妇又有了一个女儿Evie。Evie也患有SMA,但她更幸运——在她出生的几个月前,FDA批准了一种被称为nusinersen的ASO疗法,这是有史以来第一个治疗SMA的基因疗法。Evie在12天大时接受了第一次注射。
科学家们在1978年首次认识到ASO靶向RNA的能力,但花了几十年才证明其临床潜力。早期,诸如毒性和药效缺乏等问题阻碍了进展,许多制药公司失去了兴趣。但是,位于加州卡尔斯巴德的Ionis制药公司(最初名为Isis制药公司)的研究人员,对药物的化学主链进行了关键的修改,提高了药效和稳定性,使ASO能够在不被降解的情况下与其目标分子结合。
促成nusinersen诞生的工作始于2000年左右,地点在纽约的冷泉港实验室(Cold Spring Harbor Laboratory)。在那里,生物化学家和分子遗传学家Adrian Krainer正在研究导致SMN2(另一种编码SMN的基因)产生的SMN蛋白活性较低的机制。他们推断,如果他们能让SMN2产生更多的SMN蛋白,就能提高SMN1基因突变的患者体内的SMN水平。他们从其他人的工作中了解到,几乎在每个人身上,SMN2产生不稳定蛋白的原因是剪接过程中的错误——在剪接过程中,RNA链被剪断并被加工成合成蛋白质的指令。这会导致SMN2的一段编码序列被跳过。
Krainer的团队将注意力集中在与RNA链结合并导致片段丢失的沉默蛋白上,希望能阻止它们对合成完整SMN蛋白的干扰。2004年,Krainer开始与药理学家Frank Bennett合作,Frank Bennett是Ionis制药公司的创始成员之一。他们一起找到了一种ASO,这种ASO可以与信使RNA结合,并隐藏该片段,使其不被沉默蛋白干扰,从而使功能性SMN2得以产生。
2011年,这种名为nusinersen的化合物进入临床试验阶段。试验结果喜人,以至于在患有SMA的婴儿身上进行的3期试验提前终止了:接受该药的患者比接受安慰剂的患者更有可能达到运动指标并存活下来。
截至目前,全球已有超过1万人接受了nusinersen (Spinraza)的治疗,2016年Ionis将该药物授权给了总部位于马萨诸塞州剑桥的百健(Biogen)制药商。这种药物彻底改变了该病的病程:出生后不久服用此药的SMA婴儿在出生后几年内都不会死亡。盐湖城犹他大学(University of Utah)的儿科神经学家、收到Biogen公司咨询费的Russell Butterfield指出,如今,他我们不会再告诉家长,他们会尽力,但其实他们是无能为力的。相反,他们会说, 们有了一种新药,它的疗效很好,需要尽快开始治疗。
现在4岁的Evie Lewis每隔几个月就会进行一次腰椎穿刺,接受一剂Spinraza的注射,最近她又进行了第15次注射。Elliot说表示,尽管Evie仍然面临一些问题,比如必须通过喂食管进食,但她能走、能跑、能爬——这些都是Blakely无法做到的。
赛道拥挤
在nusinersen的成功之后,研究人员开始研究与明确定义的基因突变有关的其它疾病,如亨廷顿氏舞蹈病。这导致了药物tominersen的产生,该药物由Ionis开发,并由瑞士巴塞尔制药公司罗氏(Roche)获得临床试验许可。它通过靶向正常和缺陷HTT基因产生的RNA链上的CAG重复序列,并标记它们,用一种叫做RNase H1的酶来破坏这些序列。2019年发表的一项1/2期临床试验结果显示,tominersen降低了脑脊液中亨廷顿蛋白突变体的浓度,没有引起任何严重的副作用。
亨廷顿早期试验的成功引起了神经退行性疾病研究人员的注意,因为异常蛋白质积累是许多此类疾病的关键特征。伦敦大学学院的神经学家、负责tominersen的1 / 2期临床试验的Sarah Tabrizi教授指出,这让人兴奋,因为它打开了针对以毒性蛋白积累起主要作用的神经退行性疾病进行反义序列试验的大门。
但是3月底一项出人意料的宣布给亨廷顿社区带来了巨大的打击。在一个独立专家委员会的建议下,由来自18个国家的791名参与者参与的tominersen 3期试验提前终止,该委员会已对数据进行了有计划的审查。Roche在一份声明中表示,没有出现新的安全担忧,但该药的潜在好处并不超过风险。Tabrizi提出,在更多的细节公布之前,我们不可能知道哪里出了问题。
与tominersen作用方式类似的药物仍被用于治疗其它病因相似的疾病。例如,一些ALS病例是由过多的突变蛋白引起的,一些针对这类疾病的ASO正在进行临床试验。进展最快的是Ionis开发的一种用于治疗遗传性ALS的ASO药物tofersen。目前在Biogen赞助下,tofersen的3期试验正在开展中。
弗吉尼亚州联邦大学(Virginia Commonwealth University)的神经学家 Claudia Testa指出,相比于nusinersen提高活性蛋白水平,像tominersen和tofersen那样降低突变蛋白水平的药物,其实面临的挑战更多。一些降低蛋白水平的策略实际上同时降低了好的蛋白质和坏的蛋白质的水平。科学家们还不清楚tominersen的第三阶段试验是否存在这一问题。Testa表示,治疗SMA的药物起到的作用与tofersen、tominersen完全不同,因此它不能预测其它ASO对其它疾病的疗效——这是一个令人痛苦的事实。
为了避免这个问题,一些ASO直接针对突变蛋白。马萨诸塞州剑桥市的一家生物技术公司Wave Life Sciences正在测试一种策略,该策略针对的是微小的突变,这种突变有时会伴随CAG重复发生在HTT的突变副本上。这样做的目的是维持健康的亨廷顿蛋白水平。但是,这种药物只对携带这些突变的亨廷顿舞蹈症患者中的一小部分起作用。此外,Testa指出,这种精准医疗只能通过详尽的测序方法来识别,而这种方法在临床中并不经常使用。(Testa收到了来自Wave Life Sciences的咨询费。)
最近,研究人员已经开始测试基于ASO的治疗方法,用于更常见的神经退行性疾病,如帕金森病和阿尔茨海默病。绝大多数病例与特定的基因突变无关,而且这些疾病比遗传疾病更为普遍。治疗阿尔茨海默症的ASO方案旨在降低tau蛋白的水平,tau蛋白是一种会在大脑中形成有毒斑块的蛋白质。对于帕金森氏症,目标是降低α-突触核蛋白,它聚集成病理团块——路易体。
但英国牛津大学(University of Oxford)的神经学家Kevin Talbot表示,对于这类涉及神经再生的疾病来说,一个网络中的几个基因很可能参与其中。他将参与一项即将进行的、用于治疗ALS的ASO试验。他表示,目前还不清楚网络中一个基因的改变会如何影响其它基因。(Talbot此前曾在Roche和Biogen的科学顾问委员会任职。)
根据Talbot的说法,另一个问题是,这些药物目前需要反复进行腰椎穿刺,以到达中枢神经系统的靶点。Talbot指出,在ASO应用于更广泛的疾病之前,重要的是找到一种方法让这些药物通过血脑屏障,从而减少它们的侵入性。在我们洋洋得意之前,还有一大堆事情要做。
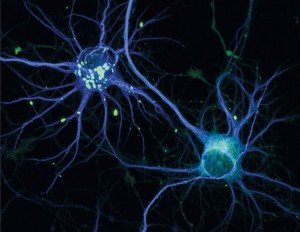
一种引起亨廷顿舞蹈症的HTT蛋白的有毒版本,形成斑块(亮绿色)。
新思路
对小鼠的研究表明,未来的ASO可能在大脑中有更强大的用途:取代失去的神经元。
去年,加州大学圣地亚哥分校的细胞生物学家Xiang-Dong Fu等人证明了使用ASO将非神经元的脑细胞(星形胶质细胞)转化为神经元是可能的。研究小组将ASO药物注射到老鼠大脑中帕金森氏症失去神经元的区域。一旦到达那里,药物就激活了一个基因网络,促使星形胶质细胞变成神经元。在帕金森病小鼠模型中,Fu的研究小组发现,接受治疗的动物在某些行为上有改善。
Cleveland参与了Fu的试验,他一直在使用Ionis提供的ASO在大脑的其他部分进行测试。他之后会一直研究这个课题。这是一种全新的可能性。
这类将星形细胞转化成神经元的ASO仍处于早期阶段。Fu警告,在这项技术应用于临床之前,还需要在非人类灵长类动物身上进行测试,因为它们的大脑与人类的大脑更相似。
目前,研究人员正急切地等待tofersen治疗ALS的3期临床试验的结果,以及更多关于tominersen治疗亨廷顿舞蹈症的临床试验停止的确切原因的信息。
Susan是一名60多岁的退休护士,她从第一阶段就参与了tominersen试验。她对这个消息很失望,但她很感激作为参与者她得到的照顾。从第一天起,Susan就有幸参与这项试验。她觉得现在只需要耐心和回顾。没有别的选择,不是吗?
原文检索:
Diana Kwon. (2021) Genetic therapies offer new hope against incurable brain diseases. Nature, 592: 181-184.
张洁/编译