第四种防御分子完善了抗病毒阵容
当Toll样受体(Toll-like receptors)发现有病毒或微生物侵略的迹象时,可以启动免疫应答。关于受体激活是如何驱动防御程序的这种新发现应有助于我们了解自身免疫性疾病。
免疫系统的内源性分支免疫细胞可以检测到细胞外或细胞内的各种感染性病原体。这个过程取决于被称为模式识别受体(pattern recognize receptors,PRRs)1的蛋白质对“非自身”分子特征的感应。在内吞溶酶体(endolysosome,细胞可摄取细胞外物质的一种细胞器)上的PRRs被称为Toll样受体7(Toll-like receptor 7,TLR7)、TLR8和TLR9,可以由病毒或微生物核酸的存在而被激活。然而,这些相同的受体往往与自身免疫性疾病中“自身”核酸的错误检测有关。Heinz等人在《自然》(Nature)杂志上报道了一种被他们命名为“TASL”的蛋白质,这种蛋白质将TLR7、TLR8和TLR9的激活与被称为I型干扰素的分子的产生联系在一起,从而介导了抗病毒防御。编码TASL的基因已经被证明与系统性红斑狼疮这种自身免疫性疾病有关,这一发现可能揭示了导致这种疾病的原因。
为了区分不同的病毒和微生物所致的疾病,并作出适当的反应,内源免疫系统在细胞内部的不同部位有不同的PRRs。并且每个PRRs都有称为病原相关分子模式(pathogen-associated molecular pattern,PAMP)的“感受器”,PAMP能识别出感染性病原体的独特标志。其中一个这样的受体家族—TLRs(图1),是在细胞表面或内吞溶酶体中发现的跨膜蛋白。大多数细胞表面TLRs可检测到细菌组分,如在细菌细胞壁中发现的脂肽。相比之下,内吞溶酶体中的TLRs,如:TLR3、TLR7、TLR8和TLR9则识别细菌核酸或其降解产物,这通常与病毒感染相关,同时也是活体病原微生物的标志。
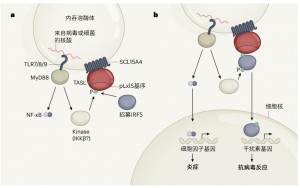
图1. TASL蛋白在激活干扰素介导的抗病毒防御中的关键作用。a,病毒或细菌的核酸可被人类免疫细胞引入称为内吞溶酶体的细胞器,并被TLRs(TLR7、TLR8和TLR9)识别。识别后能激活MyD88蛋白,然后MyD88又能激活转录因子蛋白NF-κB(感染免疫应答中关键的角色)。Heinz等人发现了一种称为SCL15A4的蛋白质是如何帮助系统性红斑狼疮这种自身免疫性疾病发生自身防御反应的。他们发现,SCL15A4与一种名为TASL的蛋白结合,TASL含有一种进化上保守的氨基酸序列,称为pLxIS基序。当内吞溶酶体TLRs识别外来核酸时,一个磷酸基团(P)被激酶(可能是来自MyD88下游通路的IKKβ)添加到TASL上。这种磷酸化将转录因子IRF5招募到了TASL上。b,然后TASL作为支架,促进IRF5被激酶(可能是IKKβ)磷酸化和激活。TASL是第一个已知介导IRF5激活的含pLxIS基序的蛋白,磷酸化的IRF5进入细胞核并驱动编码抗病毒干扰素分子基因的表达,NF-κB则驱动称为细胞因子的促炎防御分子的表达。
在与PAMP结合后,TLRs激活的同时,还会与另一种蛋白(称为适应性蛋白)结合,这种适应性蛋白提供了一个关键的控制点,启动不同的信号级联反应,最终形成防御应答。与其它的防御机制协同,可以区分出两个主要的基因表达程序,这些防御程序可广泛感知特定的病原微生物的危害。在大多数TLRs的下游是一种称为MyD88的适应性蛋白,MyD88激活了转录因子蛋白NF-κB,作为免疫反应的一部分,NF-κB驱动了促炎基因的表达。TLRs的一个亚群(TLR3和TLR4)可以与TRIF蛋白接触,TRIF作为支架,使激酶在转录因子IRF3上添加一个磷酸基团。这种磷酸化能激活IRF3,IRF3是被称为转录因子家族干扰素调节因子(interferon regulatory factors,IRFs)中的一个成员,IRF3能广泛的激活基因表达程序,产生I型干扰素分子是以上这些程序的一个标志物。
干扰素是被称为适应性免疫反应(免疫系统分支之一)的有力驱动者,因此干扰素的存在有导致自身免疫的风险。为了防止这种来自于宿主自身免疫系统的攻击,必须严格调控干扰素应答。作为一种保障措施,在IRF3被激活之前,必须先将TRIF中的特定氨基酸残基序列pLxIS进行磷酸化。这种控制机制提供了一个“许可步骤”(licensing step),这并不只是TRIF作为TLR信号传导的适应性蛋白所特有的,而是一种普遍的传感途径的标志,它能使IRF3或相关蛋白IRF7参与驱动干扰素的表达。每一个已确定的连接病原微生物核酸的识别与I型干扰素的产生的内源性传感途径,都是通过先前已知的含有pLxIS基序的三种适应性蛋白(TRIF,MAVS和STING)中的一种发出信号的,只有一个例外。因此,含有pLxIS基序的适应性蛋白可以特异地将病原微生物核酸识别与抗病毒防御连接起来。
上述规则的唯一例外是内吞溶酶体的TLRs,如TLR7、TLR8和TLR9。虽然它们能检测病原微生物核酸,并驱动I型干扰素基因的表达,但它们并不通过TRIF。相反,它们是通过MyD88来激活干扰素调节因子IRF5,IRF5在结构和功能上与IRF3和IRF7类似。先前在TLR7、TLR8和TLR9的信号级联研究中还没有发现涉及pLxIS基序的许可步骤。
有一种被称为浆样树突状细胞(plasmacytoid dendritic cells)的免疫细胞表达了高水平的TLR7和TLR9,通过产生大量的I型干扰素,在对抗病毒防御过程中至关重要。但这些细胞也是系统性红斑狼疮中的核心角色。先前对于这种疾病的基础分子机制研究已经确定了一种位于内吞溶酶体膜上名为SLC15A4的蛋白质,它负责运输多肽和氨基酸(组氨酸),已知SLC15A4与TLRs的激活有关。
为了进一步研究SLC15A4的作用,Heinz等人用质谱法探查与之相互作用的蛋白质。这种方法发现了之前鲜为研究的蛋白质TASL。TASL在内源性免疫细胞中丰量表达。Heinz等人发现,TASL通过与SLC15A4的相互作用而与内吞溶酶体结合。作者的进一步实验证实了这种相互作用是特异性的:在免疫共沉淀试验中观察到SLC15A4与TASL有结合;并且,在这些试验中相关蛋白SLC15A3和突变的SLC15A4都没有检测到它们与TASL有相互作用。
当作者建立TASL基因编码缺陷的浆样树突状细胞和被称为单核细胞的免疫细胞时,他们发现由TLR7、TLR8和TLR9所介导的信号消失了,并且当SLC15A4缺失时,也有类似的效应。Heinz等人继续阐述了TASL是通过IRF5特异性地发挥作用的,发现在缺乏IRF3或IRF7的免疫细胞中,TLR7和TLR9的激活通路仍然保持完整;但在缺乏TASL或IRF5的细胞中则激活受阻。然而,当TASL的通路被破坏时,NF-κB介导的信号传导并不受影响。有趣的是,作者在TASL中发现了一个pLxIS基序,并有证据表明,pLxIS基序的磷酸化(通过与NF-κB激活相关的MyD88下游激酶)介导了IRF5的激活。
这一发现将TASL提升为含有pLxIS基序的IRF-激活适应性蛋白专属圈的成员,其它成员是TRIF、MAVS和STING。这四种蛋白共同控制着由病原微生物核酸引发的I型干扰素应答反应,随着TASL作为TLR7、TLR8和TLR9信号传导中缺失的pLxIS适配体的发现,对这一信号传导通路的研究已经较为完整。
鉴于TASL向IRF5发出信号,但不向IRF3或IRF7发出信号,因此,确定IRF家族成员对含有pLxIS基序的不同蛋白的招募所需的结构特征将是非常有趣的。尽管作者进行了初步的实验研究,以探究这个系统中磷酸化事件的发生。但是TASL中pLxIS基序的磷酸化应当细化研究以确定负责的激酶。
此外,梳理出这个新发现的信号通路是如何调控激活MyD88分子(TLR7、TLR8和TLR9信号的关键适应性蛋白)将是非常有趣的。正如已被证明的TLRs触发的其它信号级联反应和包括多个适应性蛋白,MyD88介导的信号传递和涉及TASL的pLxIS“许可步骤”从不同的内吞溶酶体囊泡在不同的成熟阶段顺序产生。虽然TASL不参与NF-κB的激活,但作者发现,在TASL缺失的细胞中某些促炎基因的表达仍被阻断,这可能是由于IRF5激活的相关缺陷。尽管如此,在不干扰引发炎症防御反应能力的前提下提供一种抑制干扰素介导的自身免疫的方式,TASL被证明可能是治疗TLR7、TLR8和TLR9参与促进自身免疫性疾病的药物靶点。
原文检索:
Niklas A. Schmacke & Veit Hornung. (2020) Fourth defence molecule completes antiviral line-up. Nature, 581: 1-2. 郭庭玥/编译