点亮大脑的荧光探针
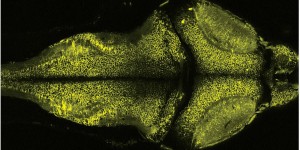
能对电压改变做出反应的荧光蛋白(Fluorescent protein),显示出了斑马鱼大脑细胞之间的神经信号。
遗传编码的电压指示开关,能够在神经元细胞传递电信号时,实时做出反应,改变颜色,这个新工具能够让我们以前所未有的角度,来研究神经的活动情况。
Douglas Storace的试验台上还贴着一张他7年前得来的大钞,那是他打赌赢的。2012年9月,Storace当时在美国耶鲁大学的博士后合作导师Larry Cohen断言,Storace不可能在小鼠的背部表达出电压敏感的蛋白质。结果Storace赢了。
那张大钞也时刻激励着目前已经是美国佛罗里达州立大学(Florida State University in Tallahassee)助理教授的Storace,他自己实验室的研究肯定也会成功。因为那就是证据,证明了可以正确地表达这些电压敏感蛋白,并跟踪这些电信号。Storace正在利用这些遗传编码的电压敏感蛋白质(genetically encoded voltage indicators, GEVI),来研究嗅球(olfactory bulb)神经元细胞是如何感知气味,并对此做出反应的。
GEVI蛋白是一种电压敏感的荧光蛋白,可以在神经元细胞活化,或接收信号时改变颜色。由于GEVI蛋白能够在靶细胞内表达,直接反映这些细胞的电信号改变情况,因此科研人员认为,它是非常理想的神经元研究工具。但是后来发现,这些蛋白太难用了。韩国科技研究院(Korea Institute of Science and Technology in Seoul)的神经学家Bradley Baker就表示,他们一直梦寐以求能够实时观察单个细胞内的电压变化。不过这些GEVI蛋白虽然听起来挺不错,可用起来却并不是那么回事。
早期的GEVI蛋白,在好几个层面上都无法满足科研人员的需求。首先,在细胞处于静息状态时,它们太亮了,可是当细胞兴奋之后(产生动作电位),这些GEVI蛋白又太暗了,以至于无法与背景分开。其次,GEVI蛋白很难集中在神经元细胞的胞膜上,但胞膜是它们发挥作用的场所。不过,科研人员也开始着手解决这些问题。比如有人开始寻找更好的荧光蛋白,或者化学染料,来改善GEVI蛋白的亮度问题。有人使用定向进化和高通量筛选技术,寻找对电压更加敏感的GEVI蛋白。越来越多的生物学家接受了这种新工具。加拿大魁北克市Laval大学(Laval University in Quebec City, Canada)的神经学家Katalin Toth就指出,以前没有太多人使用GEVI蛋白,但是现在这些蛋白变得更亮,反应速度也更快,所以也开始被大家接受了。他认为,GEVI蛋白的春天就要来了。
初露锋芒
当试验小鼠闻到了香蕉的气味,并走过去时,这就是好多大脑神经回路的共同作用结果。科研人员通过膜片钳技术(patch-clamping)和电压敏感的染料(voltagesensitive dyes),就能了解这些神经回路。
当然,研究人员也可以使用遗传探针(Genetic probes)。这也是一种与染料比较类似的标记方法,因为这些遗传探针都是荧光分子,它们也能对电信号做出反应。而且科研人员还可以只在特定的目标细胞里表达遗传探针分子。GCaMP等遗传编码的钙离子指示器(Genetically encoded calcium indicators, GECI)探针就是将能够与钙离子结合的蛋白与荧光蛋白分子融合而成的。当神经元细胞活化之后(产生动作电位),就会有大量的钙离子进入细胞,改变遗传探针分子里能够与钙离子结合的那个亚单位的构象,进而激活遗传探针分子里的荧光蛋白。
不过,GECI探针只能用于标记神经元细胞的电活动。虽然,它们对动作电位(这是神经元细胞之间交流的基本单位)非常敏感,但是并不能捕捉到更加微弱的亚兴奋(sub-excitatory)电信号,而这些信号才是帮助神经元细胞捕捉各种不同信息的关键。
1997年,美国加州大学伯克利分校(University of California, Berkeley)的Ehud Isacoff开发出了世界上第一个GEVI——电压敏感的钾离子通道绿色荧光蛋白,并取名为FlaSh。英国帝国理工学院(Imperial College London)的神经学家Thomas Knöpfel当时正在日本RIKEN研究院工作,他在2010年时,将玻璃海鞘(Ciona intestinalis)的电压敏感的磷酸酶与荧光蛋白融合在一起。2012年,他又通过随机突变(random mutation)的方法,将一种蛋白的电压敏感性提高了14倍,开发出了有史以来最成功的GEVI探针——ArcLight。
目前GEVI探针大致可以分为3大类。比如ArcLight这种电压敏感蛋白与荧光蛋白融合的产物,Archer和QuasAr2这种以荧光跨膜蛋白视紫红质(rhodopsins)为基础的产物,以及Ace–mNeon这种能量转移反应荧光蛋白(fluorescence resonance energy transfer, FRET)探针。这些第二代荧光蛋白FRET分子与光敏感的视蛋白(opsins,与视紫红质类似)融合之后,就成为了opsin–FRET探针,能够感知荧光颜色(能量)的变化。美国斯坦福大学(Stanford University in California)的神经学家Michael Lin表示,与构建方式相同的GCaMP不同,每一种GEVI都有各自不同的开发路径。
最理想的GEVI应该是可以伴随着电压的变化,产生一个背景噪声很小的、稳定的、亮度足够的荧光信号。但这只是美好的愿景。与可以全细胞表达的GCaMP不同,GEVI只有在细胞膜上表达时,才能发挥作用。而且GEVI不能用于细菌,因为它们很难在细菌的膜上形成膜电位。而且GEVI活化时的亮度也不如GECI。
神经元细胞的电活动往往在毫秒级,这对于GEVI和摄影成像也都是一个问题。产生亮度足够的荧光信号需要一个足够强的激发光,而这往往会使细胞过热,同时会让GEVI在几分钟内“熄灭”。
因此,大部分生物学家在开展比较精细的研究时,还在继续使用GCaMP来研究神经元细胞的活动。据美国弗吉尼亚州阿什本霍华德休斯医学院珍妮亚研究院(Howard Hughes Medical Institute’s Janelia Research Campus in Ashburn, Virginia)的神经学家Eric Schreiter介绍,他们这些从事神经研究的人最喜欢的就是像GCaMP这样的探针。因为他们每个人都会需要这种钙离子图像。可是目前,只有很少的GEVI报告探针可应用于活细胞,而且应用的限制也很多。
更快、更亮、更好
不过,这种现状已经有所改变了。这主要归功于定向进化技术(directed-evolution approaches)、高通量筛选技术(highthroughput screening)和更加稳定的荧光蛋白分子。
比如,Schreiter等人就将视紫红质荧光探针里的荧光蛋白组分,替换成了在电压发生改变时,能够与人工染料分子结合的蛋白。与荧光蛋白相比,这些人工染料的亮度有了明显的提高,而且光稳定性更高。比如Voltron探针就要比其前身GEVI探针的亮度高好几倍。而且光稳定性更高,15分钟都不会发生淬灭。
Voltron探针的信号非常强烈,与并未与染料结合的背景荧光反差非常明显。在显微镜下,这种负向的信号(‘negative’ signal)要比正向的信号(‘positive’ signal)更难发现,因为背景本来就是暗的。Schreiter等人接下来又在视紫红质蛋白的光子转运结构域(proton-transport domain)里发现了三种特别的突变,能够在细胞处于静息状态时,降低蛋白的荧光强度,这样一来,就打造出了“反向的”Voltron探针,可以释放“正向的信号”。Schreiter实验室的博士后,神经学家Ahmed Abdelfattah表示,这是他职业生涯里为数不多的,对蛋白质进行合理改造的工作。
日本滨松大学(Hamamatsu University in Japan)的神经学家Yuki Bando表示,这些突变还可以解决其它以视紫红质蛋白为基础的GEVI探针存在的,亮度对比不够的问题(bright-on-bright)。
还有一些科研人员使用发射红色荧光的GEVI探针,而不是发射绿色荧光的GEVI探针。这是因为,红色荧光能够进入更深层次的组织,而且对细胞的损伤也更小。比如VARNAM这种电压激活的红色神经元活动探针,就是将mRuby这种红色荧光蛋白与视蛋白结合的产物。而nirButterfly这种FRET GEVI探针能交替发射两种近红外荧光,而Ilmol探针使用的则是最亮的红色荧光蛋白,其亮度要比同为VSD类探针的FlicR1强3倍。
进一步拓展GEVI探针的荧光光谱,可以帮助科研人员在同一个研究中,同时使用多种不同的探针和技术。比如,美国哈佛大学(Harvard University in Cambridge, Massachusetts)的化学生物学家Adam Cohen等人开发出了QuasAr3探针,这种近红外探针在信噪比、细胞膜特异性表达和其他方面,都有了更进一步的提高。Cohen等人将QuasAr3探针与光遗传学研究(optogenetics)相结合,使用不同波长的光波来控制神经元的活动,对与小鼠行为和运动有关的神经细胞的电压改变问题进行了研究。
据Lin介绍,视蛋白荧光探针领域最大的进步就是细胞膜定位问题。单单这一项改进,已经非常有意义了。nirButterfly和VARNAM等探针则在荧光亮度和反应性等方面也做出了改进。
Lin等人的工作主要集中在进一步提高ASAP这种GEVI探针的反应速度方面。最新型的ASAP3探针的信号就要比ASAP2探针强不少。
更快的筛选速度
很多探针的改进工作,依靠的都是定向进化技术,即对目标蛋白进行随机突变,然后经过多轮筛选,找出我们需要的新产物。这其中的筛选就是一个大问题。加拿大Alberta大学(University of Alberta in Edmonton, Canada)的蛋白质工程师Robert Campbell就表示,对于GEVI探针的改造工作来说,筛选就是限速步骤。
美国耶鲁大学的神经学家Vincent Pieribone团队使用96孔板,开发出了VARNAM探针。他们使用的这种96孔板里,有一个电极会逐个激活每一个孔里的细胞,而每一个孔里也都含有一种突变的GEVI探针。这样就可以快速地对每一个突变探针进行检测、筛选。美国麻省理工学院(Massachusetts Institute of Technology in Cambridge)的Edward Boyden等人使用了另一种显微镜引导下的自动化方法,找到了亮度更高的视紫红质探针。
Lin的课题组使用的是电穿孔(electroporation)这种传统的遗传学技术,来完成筛选工作。电穿孔技术会发射一道短暂的电流,将静息细胞的膜电位降低至0左右,在细胞膜上打出一个小孔,以便让胞外的DNA等物质进入细胞。正是由于电穿孔技术会带来一个电压改变,因此也会产生一个荧光信号。Lin提到,这个方法是不是非常简单?但是之前从来没人使用这种方法来进行探针筛选。
这些高通量的筛选方法可以帮助我们在数小时内,完成好几千个GEVI探针的筛查工作。Campbell表示,大力推广这些筛选技术,可能才是帮助GEVI领域继续发展,进一步拓宽应用领域的正道。
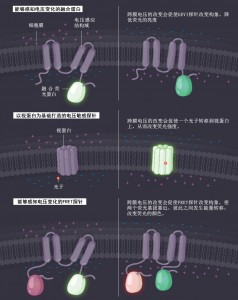
三种不同荧光探针的工作原理
科研人员们开发出了不同工作原理的电压敏感的荧光探针。第一种就是将钠离子通道等能够感知电压变化的蛋白与荧光蛋白相结合,开发出的能够感知电压变化的融合蛋白。第二种就是以视紫红质蛋白等视蛋白为基础,开发的电压敏感的荧光探针。第三种就是能够感知电压变化的FRET探针。
应用前景
GEVI探针的开发者往往都会和其他人合作,用果蝇、小鼠或人体细胞,对他们开发出的探针进行检测。虽然独立的科研人员也可以从美国麻省的非盈利机构Addgene处获得GEVI探针。不过很少有外部用户发表论文的例子。
Toth认为,这可能是设备(instrumentation)的原因。Toth的实验室就与ASAP探针的开发者合作,并且使用了随机存取双光子显微镜(random-access two-photon microscopy)来捕捉信号。但这这些系统太昂贵了,不是普通研究人员可以负担的。
另外一个障碍就是,我们很难对GEVI探针进行直接的对比。大多数实验室在报告GEVI探针的表现时,使用的都是通用标准。这有助于研究人员对不同的探针进行比较。但是到今年为止,也只有Bando等人开展的一个研究,在同一个实验条件下,对不同的GEVI探针进行了平行比对。据Bando介绍,每一种GEVI探针都有各自不同的特点,但是并没有人在相同的实验条件下对这些探针进行比对。
Bando等人使用小鼠动物和体外培养的神经元细胞,宽视野成像(widefield imaging)和双光子成像(two-photon imaging)这两种不同的成像技术,一共对8种GEVI探针进行了比较。他们对动作电位跟踪性能,突触输入(synaptic input)、光淬灭,及其他几项探针性能进行了测试。结果发现,有些探针发射的基线荧光比较暗,因此需要更强的激发光,而这就可能会使细胞过热,对细胞造成损伤。有一些探针在传统成像技术下的速度很快,信号也可靠,但是并不适用于双光子成像技术,因此可能无法应用于活体动物的深部组织研究工作。还有一些探针的信号很强,但是持续时间很短。总而言之,并没有一种探针可以在体内,同时用于检测动作电位和突触输入信号。而且只有ArcLight这一种探针可用于双光子成像技术的活体观察工作。
但是ArcLight探针的反应速度太慢,无法对只存在大约1毫秒的神经元细胞的动作电位进行跟踪。不过,由于ArcLight探针的稳定性和清晰性都很好,Bando等人还是决定以它为基础,进行进一步改进。在开展实验,选择电压探针的时候,如果使用单光子成像技术对体外培养的细胞,或者脑组织切片进行观察,那么Bando就建议使用Archer、QuasAr和Ace2N–mNeon等探针。如果要使用多光子成像技术对活体动物的深部脑组织进行观察,那么应该使用ArcLight探针。
Baker也认为,对于初次接触GEVI探针的新人来说,ArcLight探针更容易上手,是最简单的一种选择。Baker表示,不匹配的成像技术,光损害、蛋白表达量低或异常都会造成探针使用失败。所以,需要选择一个不容易出错的探针。ArcLight探针也许不是最合适的,但是如果连它都不亮,你选择其他GEVI探针也不会亮的。
实际上,Storace认为,ArcLight探针的延迟性可能正是它表现优异的原因。因为延迟性的存在,所以ArcLight探针能够将多个神经元细胞信号“整合”成一个信号,起到了“放大”的作用,所以更容易被观察到。
大脑是主要的研究对象,这也是一个重要的原因。比如Storace主要研究嗅觉系统。我们知道,嗅觉系统是由一个个嗅球组成的,每一个嗅球都对一种气味物质进行反应。这就非常适合用GEVI探针来进行研究,因为虽然我们可以识别每一个细胞的信号,但是只有整体的信号才有意义。Storace表示,这对于他们做嗅觉研究的人很有意义,但他不知道是否同样适用于其他大脑区域的研究工作。
实际上,随着科研人员不断开发出更多、更好的探针,我们也不断地设计出了新的研究策略,当然,也会暴露出更多的优势和缺陷。Storace指出,不同的探针适合解决不同的问题。大约在4、5年之内,我们一定会想到更好的、更简便的方法,来使用GEVI探针。
原文检索:
Jyoti Madhusoodanan. (2019) GENETIC LIGHT BULBS ILLUMINATE THE BRAIN. Nature, 574: 437-439.
Eason/编译