免疫共沉淀技术何去何从?
免疫沉淀可用于定位甲基化或转录因子结合的位置等DNA变化,但可能需要与假抗体进行斗争。
尽管ChIP-seq、DIP-seq和相关技术可以提供全基因组测定的相关信息,但它们并非总是有效。
染色质免疫沉淀(chromatin immunoprecipitation, ChIP)或DNA免疫沉淀(DNA immunoprecipitation, DIP)结果有误,并不是偶发事件。ChIP是间接表征基因功能的一种试验技术。为了找到转录因子(transcription factor, TF)或组蛋白标记与待研究基因组的结合位点,实验室可能会选择ChIP-seq方法,使蛋白质和DNA发生交联,然后剪切染色质,用识别待研究的转录因子或组蛋白标记的抗体进行免疫沉淀,然后对与转录因子或组蛋白结合的序列进行测序。DIP-seq可用于定位DNA变化,例如甲基化。林雪平大学(Linköping University)的研究员Colm Nestor表示,ChIP-seq和DIP-seq一直是“表观遗传学研究的基石”,该领域基于这两种方法从基因特异性表观遗传学转向了全基因组的表观基因组学。他表示,这两种技术都很便宜,相对容易实施,并且“在正确实施的情况下,结果非常稳定”,因此被广泛使用。
ChIP-seq实验中使用的抗体很多时候并不像实验室设想的那样具有特异性。一些基因组位点可能非常“粘”,粘住了其它蛋白,或在某些条件下,失去“粘性”,没有粘住特定蛋白。正如丹娜法伯癌症研究院(Dana Farber Cancer Institute)的研究人员Xiaole Shirley Liu和Clifford Meyer指出的那样,ChIP-seq潜在的一些偏差在于抗体特异性缺失问题、染色质剪切问题、交联问题或测序问题。为了对抗ChIP-seq和DIP-seq伪迹,排除实验性故障是不可避免的。 尽管一些故障并不是抗体的锅,但是当实验室进行故障排除时,一定要优先考虑抗体的特异性。以下是两个免疫沉淀(immunoprecipitation, IP)故障案例,两家抗体公司的研究人员对此评论了ChIP-seq和DIP-seq技术面临的挑战。
ChIP-seq数据可靠性受质疑
ChIP-seq使科学家能对整个全基因组进行分析,因为利用该技术,正如慕尼黑大学(Ludwig Maximilians University)的研究员Peter Becker所指出的,能够“在整个基因组的背景下,展示成千上万的结合位点。例如,通过比较多次实验的ChiP-seq数据,研究者可以产生关于不同结合的生理功能的假说。他的前博士生、现在在哈佛大学(Harvard University)Peter Park实验室做博士后的Dhawal Jain表示,ChIP-seq实验在功能基因组学中是必不可少的,因为其能提供转录因子的生理功能的重要信息。他在表征任何新型DNA结合因子时,都会选ChIP-seq作为首选实验,并且获取“高度可信”的数据至关重要。他和Becker都对他们的数据的可靠性感到不安。
当Jain还在Becker实验室读博时,他们正在研究核小体重塑。核小体是DNA及缠绕着DNA的组蛋白组成的复合物,核小体重塑复合物在某些DNA位置打开转录“窗口”。重塑复合物与DNA的相互作用往往在瞬间完成,因此很难捕获和表征。Jain表示,通过使用针对这些重塑因子的抗体开展ChIP-seq实验,该团队希望找到较宽的信号峰。他们非常惊讶地发现,在不存在核小体的染色区域,居然也有很窄的信号峰。Jain还指出,这些信号对他们来说是惊人的。
他们调查并鉴定了大约3000个具有非特异性ChIP富集的基因位点。为了验证实验结果,他们敲除了重塑复合物的2个因子,并得到了类似的ChIP-seq结果。他们发现了假阳性信号:虚幻峰(Phantom Peak)。这些虚幻峰影响了他们的数据质量,并可能影响了许多实验室和数据库中的数据。Becker表示,大多数虚幻峰位点都处于启动子位置,其中许多蛋白质与无序结构域结合,非特异性抗体结合可能是罪魁祸首。Becker还提醒,虚幻峰峰值比较低,通常在具有强烈特异性特征的实验中被忽视。但是一旦你的ChIP反应由于各种原因效率低下,并且你的特定峰值很低,那么虚幻峰就会出现。该团队建议谨慎地解读ChIP-seq峰值。Becker等人在自己的论文中列出了虚幻峰列表,为他人提供参考。为了排除虚幻峰,他们建议进行敲除或敲减实验。Jain认为,如果目标分子过于重要,敲除或敲减可能不可行。Becker则指出,输入控制可能会有所帮助。
即使实验室通过蛋白质印迹(western blots, WB)和免疫荧光(immunofluorescence, IF)确定了抗体特异性,非特异性结合也可能成为问题。该团队也遇到了这样的问题。Jain表示,非常棘手的一个问题是,在一种验证试验中起作用的抗体在另一种验证试验中可能不起作用。然后,实验室尝试使用WB或IF验证抗体的特异性,并尝试使用正交抗体重现ChIP-seq谱。但正交生成的ChIP-seq数据不一定能消除虚幻峰。他们还发现,使用完全不相干的抗体,如抗GFP,也能得到ChIP-seq富集信号。Jain指出,总的来说,人们越来越意识到基因组的某些区域无法通过ChIP实验检测,只会得到假阳性数据。Becker表示,研究重塑因子,尤其是ACF1和RCF1时遇到的一个问题是,由于它们与DNA的相互作用是瞬时的,因此无法很好地与染色质发生交联。从根本上说,他们实验中用的抗体质量很好,但还是存在非特异性结合。从最开始,他们就给ACF1添加了一个DNA结合域,使其连接到DNA,最好可以对其进行ChIP分析。从本质上来讲,该问题还是与抗体的非特异性结合有关。
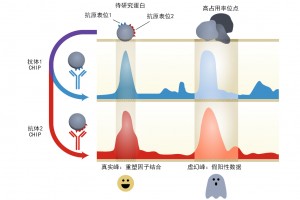
ChIP-seq数据可能会出现“虚幻峰”,这些“虚幻峰”与待研究蛋白并不对应。使用两种正交抗体进行验证可以排除这种假信号。但这并不总能奏效。例如,抗体可能非特异性地结合与开放染色质互动的蛋白质。
DIP-seq的致命BUG
林雪平大学(Linköping University)的Nestor表示,基于抗体的技术可用于研究新发现的表观遗传变化,如N6-甲基腺嘌呤,因为生产靶向这些表观遗传变化的抗体并不困难。因此,研究人员不必每次在检测到新的表观遗传标记时都必须开发特异性检测该修饰的方法。Nestor有十多年的DIP-seq经验,先免疫沉淀富集高甲基化的DNA片段,然后对其进行测序。Nestor、他的博士生Antonio Lentini和团队中的其他人并没有预想到DIP-seq技术也存在漏洞,但事情就是这样不凑巧。据该团队称,DIP-seq数据中50%至99%的富集区域可能是误报。他们发现了一个基因组区域的非特异性富集,该区域被称为短串联重复序列(short tandem repeat, STR)。其它已知的伪信号来源包括:实验室主要使用的5-甲基胞嘧啶(5-methylcytosine, 5mC)抗体优先富集低CG含量的基因组区域,最常用的5-羟甲基胞嘧啶(5-hydroxymethylcytosine, 5hmC)抗体在基因组的高度修饰区域也是如此。
在对已发表的DIP-seq研究的分析中,他们发现低丰度基因组修饰,如5-甲酰基胞嘧啶和5-羧基胞嘧啶具有最高的假阳性率。他们一直在研究这些修饰以探索DNA甲基化在人类T细胞中的作用。他们在免疫球蛋白G(IgG)对照组中注意到“特殊的”结合模式。他们发现,多达95%的已发表作品不包括IgG对照组。Nestor指出,他一直使用DIP-seq技术,而没有适当设置IgG对照组,因此他也没有立场指责其他人。
该团队用缺乏5mC和5hmC修饰的胚胎干细胞验证了他们的结果。抗体仍与STR位点结合。也许单链DNA会与IgG抗体结合。Lentini推测STR结合可能提供功能性线索,并且可以设计出能抑制这种结合的抗体。他指出,在此之前,我们最好的选择是了解这些问题并控制它们。该团队表示,避免假阳性,并纠正这种观察到的脱靶结合,最好的方式是设立IgG对照组,这可以将信噪比提高三倍,实验室可以因此检测出更微妙的DNA修饰变化。Nestor表示,“输入”是DIP试验的标准对照,一般指的是pre-IP的染色质样品。作为一名博士后研究员,他记得曾有人建议他避免使用IgG做对照,因为它们会给实验增加太多噪音。但研究人员表示,输入是一种高度不一致的对照组,并且DIP-seq极大地高估了哺乳动物基因组中的5-modC修饰。虽然Nestor和其他人使用计算工具来过滤DIP-seq数据,但他担心数据集中本身就自带大量错误。
另一个挑战是细菌污染。通常感染支原体和大肠杆菌的细胞培养物显示出高水平的N6-甲基腺嘌呤(N6-methyladenine, 6mA)修饰,该修饰在哺乳动物中很少见,但在微生物中很常见。 Nestor指出,6mA仍然是一个谜。它很难被发现,没有一种技术可以在哺乳动物中可靠地检测到它,因此它仍然是一个需要探索的难题。他想知道“6mA这个神秘的DNA修饰的功能到底是什么” 。巴斯大学(University of Bath)的Andrew Chalmers建议,当科学家选择实验(包括ChIP-seq实验)用的抗体时,可以看看他人在相关试验中使用过的试剂。Chalmers共同创立了CiteAb网站——一个在线资源,用于查找有关抗体的已发表文献和公司信息。他表示,关于抗体验证的“五大支柱策略”(注:国际抗体验证工作组为验证抗体的特异性提出的5个验证策略,包括基因策略、正交策略、独立抗体策略、标签蛋白的表达和免疫捕获及质谱分析。具体参见https://www.xianjichina.com/news/details_59686.html)并不完美,但它是讨论和分析抗体验证的良好框架。通常情况下,他人的实验可能与你有很大不同,但可用的数据和来自其他人的、来之不易的经验教训可以提供宝贵的参考。
敲除/敲减
抗体公司Abcam的研究和开发团队负责人Velibor Savic表示,抗体实验既有靶向效应,又有脱靶效应。实验人员在ChIP中,也需要减少目标信号。ChIP-seq是敏感的,因此ChIP-seq中的脱靶信号比其它技术更明显。这使得敲除和敲减在ChIP-seq中至关重要。有了这个,从一堆信号中挑出目标并找出正确的峰值会容易很多。
即使是瞬态相互作用也会产生深远的影响。Savic指出,但通过ChIP很难捕捉到这种瞬间互动。目标结果可能会混杂到背景中,因为在给定时间只有一些互动位点被占用。探索稳定住这种瞬时互动的方法非常有用。使用靶标的敲减或功能性敲除能排除脱靶结合和非特异性相互作用。在大多数情况下,这可以很好地确定实验样本中目标蛋白质的位置,以及敲除该蛋白后的背景模式。他认为,ChIP提供的只是DNA交互谱的平均静态图像,而DNA交互是动态的。人们不能从一张静止的图像中判断出一部电影,同样人们也无法从单一的ChIP实验中得出动态的结论。ChIP-seq数据只是提供功能性洞见的第一步。

Velibor Savic表示,一个蛋白能够和与其互动的DNA发生交联,并可能与周围的DNA序列产生非特异性的交联。
交联
Savic表示,交联是最关键的变量之一,需要在任何ChIP计划中进行优化。甲醛是标准的交联剂,但甲醛具有很大局限性。它最适合连接DNA和蛋白质,以及定位与DNA直接和强烈相互作用的蛋白质,如组蛋白。但甲醛在捕获瞬态相互作用或通过蛋白质复合物介导的相互作用上表现不佳。更优化的交联剂可能更好。单独或与甲醛结合使用这些交联剂,可能是提高交联效率,以便后续检测的关键步骤。蛋白质可以与它相互作用的DNA发生交联,并且可以与附近的DNA序列进行非特异性交联,这些DNA序列可以随机分布在细胞群中,并与背景信号混杂在一起。但是测序中意外的峰值取决于免疫沉淀的靶标。通过非随机相互作用,例如具有序列特异性启动子的相互作用,DNA片段可以与靶蛋白pulldown,即使它不直接与其结合。剪切和超声破碎的质量是两外两个重要因素。根据染色质固缩,蛋白质-DNA相互作用和许多其它因素,一些结构交联或破碎的效果不一。最终在IP反应中就会出现大于1 kb 的DNA片段,增加脱靶pulldown的概率,并且“超声抗性”区域可以产生假阳性结果。
负责抗体公司Cell Signaling Technology的表观遗传学和ChIP产品开发的Chris Fry表示,Chip实验方案的主要区别在于用于片段化染色质的方法。基于超声处理的方法使染色质受到严酷的变性条件的影响,包括高热、多种洗涤剂和强剪切力,这些都会损害抗体表位和染色质完整性。转录因子和辅因子的变性条件并不一致。实验室可以尝试较低的洗涤剂浓度或使用不同的甲醛浓度进行交联。正如Fry所说的那样,对于成功的ChIP,染色质片段长度和完整性非常重要。许多实验室对染色质进行过度超声,认为较短的片段更适合ChIP-seq。然而,这种过度超声会破坏染色质,常常导致靶蛋白和靶基因信息丢失。
Fry指出,用微球菌核酸酶进行酶促消化可以切割核小体之间的连接区域,并且可以更轻柔地分离染色质,可能更适合用于转录因子和辅助因子的ChIP。他从客户那里听到的一个“抱怨”是,该方法更适用于开放染色质区域。然而事实并非如此。Fry认为,与酶促断裂相比,超声处理可能更倾向于开放染色质区域。实验室必须选择是用蛋白A和蛋白G磁珠进行IP。两种方法都适用于兔抗体,但小鼠、山羊和绵羊来源的抗体与蛋白G的结合更好。实验室应使用经过测试和验证的ChIP-seq磁珠。Fry一直建议使用磁珠,不仅是为了方便,还因为它们通常比琼脂糖或琼脂糖珠产生的背景更低。
Fry指出,鉴于染色质片段化和DNA文库制备的不同方法,ChIP-seq实验具有固有的高非特异性背景信号,即一些非特异性结合的DNA片段。即使抗体具有高度特异性,与目的蛋白结合强烈,这些片段也会粘附在蛋白质、珠子或管子上。这就是为什么在实验中设置“阴性对照组”很重要。
对于ChIP-qPCR,Fry和他的团队建议使用正常IgG作为阴性对照来检测非特异性富集。对于ChIP-seq,在他看来,首选的阴性对照是输入染色质。作为ChIP-qPCR和ChIP-seq的阳性对照,实验室可以考虑已知结合目标蛋白的基因组区域或使用抗组蛋白H3的抗体作为“通用”阳性对照,因为如果染色质完整,IP试验成功,那么使用这种通用阳性对照,任何基因组基因位点都会富集。Fry指出,总有很多人在没有任何阴性或阳性对照的情况下进行ChIP实验,这点让他很惊讶。
Chris Fry指出,错误位置的富集是他推荐使用经过验证的抗体进行ChIP实验的一个原因。
抗体策略
Fry表示,错误位置的富集是他推荐使用经过验证的抗体进行ChiP实验的一个原因。实验室可以询问供应商有关ChIP或ChIP-seq验证的信息,然后仔细研究这些分析中富集水平和信噪比的数据。他认为,背景不干净的WB或IF或免疫组织化学(IHC)中的不正确定位可能会在ChIP检测中导致潜在的非特异性结合。对于组蛋白修饰抗体,实验室应该寻找支持研究修饰特异性的数据,如组蛋白肽阵列数据。该测定法全面测定抗体对修饰位点的特异性,并有助于揭示相邻修饰对抗体结合的影响。利用专有的组蛋白肽阵列,Cell Signaling公司的科学家测试了组蛋白甲基赖氨酸、乙酰赖氨酸和甲基精氨酸抗体的特异性,他们将根据客户的要求提供任何抗体的数据。在准备ChIP实验时,Fry建议研究人员仔细选择方案和试剂。组蛋白非常丰富,与DNA结合非常强,相对容易ChIP。 转录因子表达不太丰富,与DNA的结合较不稳定,相对难ChIP。通常不直接接触DNA并且可能属于大蛋白质复合物的转录辅因子是最难ChIP的靶蛋白。
在评论DIP-seq技术的缺陷时,Savic表示,相比于DNA修饰,表位是更难靶向的目标。组蛋白修饰抗体可以对特定修饰具有特异性,例如赖氨酸三甲基化,但抗体只识别其中具有修饰靶标的约8个氨基酸。核苷酸修饰也是如此。毫无疑问,侧翼的组成会在一定程度上影响抗体的结合。他表示,潜在地,对同一目标使用额外的、对侧翼序列具有不同的亲和力的抗体,可以缓解这个问题。购买ChIP抗体的科学家应该选择与交联染色质中的靶标结合、并以其天然形式识别靶标的抗体,并在整个沉淀和洗涤过程中维持与珠子和靶标的结合。理想情况下,在开展更大的ChIP-seq实验计划之前,都应该对这四个因素进行测试。
抗体用量问题
验证应始终包括抗体滴定。Fry指出,客户仍然告诉他,每次ChIP实验中免疫沉淀需要使用多达5到10 μg的抗体,这是不正确的。更多并不总是更好。对于许多抗体,无论是多克隆还是单克隆抗体,他和他的团队发现每种抗体的最佳使用范围是0.5-2 μg/IP。添加过多抗体可能会影响靶标富集。
Savic表示,增加抗体用量以进行故障排除将带来可变结果。增加抗体用量似乎是一种有希望的提高信号的方法,然而,它也可能增加来自脱靶相互作用的信号。脱靶信号可能与背景噪声混合,且一旦脱靶峰值会变得更加突出并且类似于阳性峰,增加抗体用量可能会产生更多的假阳性。他还提醒,使用靶向同一蛋白质的多种抗体的混合物可能是有效的解决方案。如果各个抗体靶向目标蛋白的不同位点,那么这些抗体可以同时与靶标相互作用,从而增加IP珠粒洗涤期间目标蛋白保留下来的概率,同时提高信噪比。但他建议谨慎行事:多克隆抗体“通常仅针对有限大小的肽而产生,因此实际上可能与ChIP分析中的单克隆抗体效果相当。”在这种情况下,了解生产多抗用的免疫肽,以确认多抗靶向目标蛋白的哪一部分就非常有用了。多种抗体的使用不适用于组蛋白修饰,因为每个靶蛋白只有一个靶标,仅能与一种抗体结合。

Nestor实验室表示,通过以IgG对照组标准化DNA修饰富集数据,可以最好地避免假阳性和剔除脱靶结合数据。
是否经过验证
一些抗体公司如Abcam和Cell Signaling Technology都会对ChIP抗体进行验证。Fry表示,当购买未经验证的抗体时,实验室需要测试和优化用于ChIP测定的抗体,例如,使用ChIP-qPCR滴定抗体并观察已知靶基因的富集,使用对照组,或考虑测试多种抗体来靶向同一种目标蛋白质或蛋白质复合物。他还指出,仅仅因为抗体未经ChIP验证并不意味着它会使ChIP失败。它可能还没有经过测试,你将是第一个测试它的人。科学家可以查阅IP数据,以获得抗体更可能在ChIP中起作用的证据。如果一个抗体经过IF或IHC验证,那么它在ChIP中有效的概率更大,因为这些实验涉及细胞固定和蛋白质在其更天然的构象下的表位识别。如果抗体在IF或IHC或两者中信号不够清晰明确,那么ChIP测定中的非特异性结合几率会增加。不幸的是,并非所有“验证”都是可靠的。例如,某些公司使用“ChIP Grade”标签,但不提供任何验证数据来支持该标签。
抗体问题
哈佛大学韦斯研究所(Harvard University’s Wyss Institute)的博士后研究员Hiroshi Sasaki需要在自己开展的单细胞超分辨率染色体成像研究中减少噪声和假阳性。他指出,ChIP-seq对于研究全基因组染色质状态非常有用,并提供了大量数据用于统计分析。许多实验室已开始在单细胞生物学中使用该方法,但很难改善信噪比。大多数单细胞数据都受到非特异性信号的影响,这些信号无法通过群体分析来消除。Sasaki等人在他们的单分子定位成像中看到了抗体标记和抗体误定位的非特异性信号,而且寡核苷酸探针也存在噪音。所有问题,包括抗体和寡核苷酸探针的特异性、批次间稳定性、实验方案优化和实验验证,在现代生物学中越来越重要。
Nestor表示,抗体选择和验证都不容易。在科学界承认结果之前,研究人员可以做的验证实验的数量也是有限的。他和他的研究小组发现,一些DIP-seq错误并不在于抗体本身,而在于实验者如何设计对照组。实验室也可以考虑无抗体技术,并在其它实验室中独立重复该方案。他还指出,正如他们所发现的那样,如果误差足够普遍,那么各个实验室都容易出现一致的错误,也算是后果自负吧。
原文检索:
Vivien Marx. (2019) What to do about those immunoprecipitation blues. Nature Methods, 16: 289-292.
张洁/编译






