细胞器互作变革生物研究
细胞器的功能远比科学家预想的要复杂得多。
30年前,Jean Vance发现了细胞内部的基本结构时,她的研究并没有引起人们的广泛关注。她甚至一度对自己的研究产生了怀疑。
经过后续研究后,她的成果才得到了学界的认可。当时她刚在加拿大阿尔伯塔大学(University of Alberta)建立了自己的实验室,开始独立开展研究。她认为,自己从大鼠肝脏中分离出的是一批名为线粒体(细胞的能量工厂)的细胞结构。但测试显示,她的样本中含有一些不应该存在的东西。据Vance回忆,她当时还以为,自己犯了一个大错。
经过额外的纯化步骤后,她发现细胞内一些其它组分粘附在线粒体上,就像粘在鞋子上的口香糖一样。这些混入的杂质其实是内质网(endoplasmic reticulum, ER)的成分。内质网是细胞合成蛋白质和脂质的装配工厂。其他生物学家在研究中也发现了内质网,但却将其看成了实验操作引入的杂质。但Vance意识到,这些碎片黏在线粒体上是有原因的,她随后的发现解决了细胞生物学领域的一大谜题。
在1990年的一篇论文中,Vance指出内质网和线粒体之间的连接点是脂质合成的关键。这两种细胞器的结合处可以作为新合成的脂肪转移的端口。这回答了一个长久未得到解答的问题——线粒体如何接收脂质。新合成的脂质通过连接处,从内质网转运进线粒体。
尽管如,当时学界仍普遍认为,线粒体纯化中出现的粘性物质是污染,对Vance的成果继续持怀疑态度。虽然Vance做了几次演讲,但人们还是不相信她的研究结论。
但在二十多年后的现在,Vance的论文被视为一个里程碑——它改变了科学家对细胞如何在其挤满线粒体、细胞核和内质网等细胞器的内部维持秩序和功能的理解。研究人员现在认识到,细胞器之间的相互作用无处不在,各种细胞器之间一直保持密切对话。通过探索这些互作,科学家们发现了负责细胞器之间的联系,并保持细胞健康的那些蛋白质。
细胞器交流的最新观点迫使人们重新思考细胞生物学。霍华德休斯医学研究所珍利亚研究园区(Howard Hughes Medical Institute’s Janelia Research Campus)的细胞生物学家Jennifer Lippincott-Schwartz表示,这些细胞器内正在进行另一层沟通。他的团队一直在拍摄细胞器之间沟通的视频。
多亏成像技术的进步,研究人员现在可以观察到彼此相距10-30纳米的细胞器,这个距离小到甚至连病毒颗粒都无法从中经过。这些接合点形成了交换脂质、离子和其它分子的端口。如果打破这些联系,就会引发细胞功能障碍,甚至导致癌症、糖尿病、阿尔茨海默病和其它各种疾病。
首次发现
事实上,在Vance的论文发表的40年前,就有科学家首次报道了细胞器之间的接触。在20世纪50年代,法国的显微镜学家拍摄了线粒体图片,发现大鼠细胞中线粒体与内质网紧密连接在一起。但当时的生物学家并不认为,这种近距离接触具有生理学功能。
在20世纪60年代和80年代之间,其他一些科学家发现,内质网与其它细胞器——包括高尔基体(细胞的中央分选和运输中心),以及包裹细胞的脂肪质膜——连接在一起。然而,这些连接被视为是巧合——算是细胞内通信规则的例外。
伦敦大学学院(University College London)的细胞生物学家Tim Levine将这些早期发现命名为“非范式(Non-paradigmal)”,并认为它们很容易被忽视。过去半个世纪的教条认为,大多数细胞内的物质输送都是通过名为囊泡的泡状囊来实现的。这些囊泡就像微型的邮政系统一样,将物质包裹起来,从一个细胞器运送到另一个细胞器。
还有另一个因素导致了这些早期发现被忽视:研究囊泡的科学家通常不会与研究钙信号的学者进行交流。Levine指出,这两个领域彼此隔离,接触很少。
在这种背景下,Vance于1990年发表了那篇里程碑式的论文,但在长达十年里,该论文甚少被引用。直到过去十年,研究人员开始精确定位连接细胞器的特定蛋白(被称为衔接蛋白)时,该领域才重新评估了她的作品。深入研究这些蛋白意味着细胞生物学家可以人工构建接触点或将其破坏,并在此过程中探索细胞器互作的功能。
例如,在2009年,现在就职于英国牛津大学(University of Oxford)的细胞器生物学家Benoît Kornmann领导的研究小组发现了一组由四种蛋白质组成的细胞机器,形成了酵母细胞中内质网和线粒体之间的衔接点。删除任何一种蛋白质将会导致衔接点分解,并引发脂肪交换缺陷,减慢细胞生长速度。
就职于以色列雷霍沃特魏兹曼科学研究所(Weizmann Institute of Science)、参与了该研究的酵母细胞生物学家Maya Schuldiner表示,这是首个表明能找到并操控细胞器间衔接点的研究。
衔接点
很多时候我们都无法直接证明某个分子是衔接点。这是因为通常两个细胞之间的衔接点由多个蛋白组成,这些蛋白就像积木一样,仅仅移除一个可能并不会导致结构崩溃。
纽约州伊萨卡市康奈尔大学(Cornell University)的酵母生物学家Scott Emr在开始研究内质网和质膜之间的接触部位时就遇到了这种情况。他的小组最终发现了6个束缚蛋白,其中任何一个都能维持衔接点的正常功能。他的团队只能通过消除所有六种蛋白质来破坏这种联系。
由于细胞器之间的相互作用网络精细而复杂,识别衔接蛋白的任务也变得异常复杂。起初,所有的互动似乎都涉及到内质网。随后科学家开始记录其它互作。他们很快意识到,当直接物质运输通道被堵塞时,细胞可以更换运输通道。
2014年,德国奥斯纳布吕克大学(University of Osnabrück)的Schuldiner团队和Christian Ungermann团队各自独立报道了这一现象。在敲除了酵母中内质网和线粒体之间的经典衔接后,两个团队都发现脂质仍然可以通过液泡以接力的方式在两个细胞器之间运输。这种充满液体的囊泡充当细胞的储存柜,用于存储食物和其它营养物质。
其它研究则揭示了更复杂的衔接点。加利福尼亚大学戴维斯分校(University of California, Davis)的线粒体生物学家Jodi Nunnar和她当时的同事,细胞生物学家Laura Lackner鉴别了衔接三个细胞器(内质网、质膜和线粒体)的两个大型连接点。对此,现就职于西北大学(Northwestern University)的Lackner指出,看起来这似乎是细胞内的某种功能中心,它提示了细胞内的另一种空间组织。
功能连接
Schuldiner表示,所有关于连接点的发现让更多的研究人员开始关注细胞器相互作用研究。她指出,科学家开始意识到,所有这些互作肯定还有其它功能。
研究人员最早发现的功能之一是物质运输。在Vance的最初发现之后,实验表明,细胞器接触几乎像是两艘船之间交换货物的舷梯。这些连接点能转运胆固醇和其它脂肪分子,否则这些脂肪分子就会在水状的细胞质中形成小液滴,像排水管中的培根油脂一样堵塞细胞运输。
钙、过氧化氢和其它水溶性化合物也可以经由这些连接点运输,这有助于细胞聚集这些分子然后进行特定反应。例如,Schuldiner等人去年发现线粒体有时会与细胞的毒性清除中心(过氧化物酶体)进行接触,从而聚集分解脂肪所需的某种分子。
除了作为物质运输通道之外,这些连接点在调节细胞器分裂方面也起着至关重要的作用。2011年,科罗拉多大学博尔德分校(University of Colorado Boulder)的细胞生物学家Gia Voeltz领导的团队的研究证实了这一点。该团队对酵母细胞进行分层成像,以创建内质网—线粒体连接的高分辨率3D模型。Voeltz认为内质网看起来就像是手掌,夹住并挤压线粒体。随着时间的推移,线粒体的连接点部分发生收缩,并分裂成两部分。
几年后,Voeltz发现,类似的过程也发生在内体的分裂过程中。内体是一种与膜结合的囊泡类细胞器,是细胞内吞作用中运载途径的一个区室。她指出,最初,大多数科学家怀疑内质网—内体接触的存在及其重要性。现在大家都接受了这一概念,并且Voeltz认为这些连接点的视频是强有力的证据。面对视觉效果,怀疑者很快会被说服。人们会说:“哇,这太棒了。没想到细胞器之间的联系这么漂亮。”
Voeltz使用传统电子显微镜拍摄了最详细的细胞器互作电影。在过去几年中,更先进的成像技术使得所有细胞器的接触点更加明显。
2017年,Lippincott-Schwartz与他在珍利亚研究园区的同事,显微镜专家Eric Betzig合作,使用超分辨率光学显微镜捕捉6种细胞器(内质网、线粒体、高尔基体、过氧化物酶体和名为脂滴的脂肪沉积物)之间错综复杂的相互作用的彩色3D电影。一周后,耶鲁大学(Yale University)的神经科学家Pietro De Camilli领导的一个小组发表了黑白电影,显示内质网在小鼠神经元中与线粒体和其它细胞器发生连接,并互作。
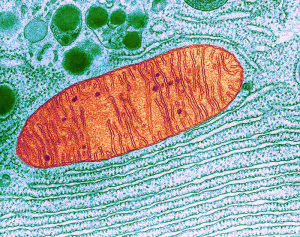
在细胞中,线粒体(红色)出现在内质网附近。内质网是细胞内合成蛋白质和脂肪的工厂(图中下部绿色的部分)。
作为视频证据的补充,Schuldiner和魏兹曼科学研究所的细胞生物学家Einat Zalckvar带领一个团队,系统地绘制了酵母细胞中所有的接触点,并展示了一种鉴别衔接蛋白的方法。他们在去年5月的报道中使用了一种分裂式荧光探针。两个探针就像两个互锁的心形吊饰一样,可以组合在一起形成完整的图像。当两个细胞器紧密结合在一起时,两个探针结合起来,就会发光。
在未发表论文的后续工作中,研究人员确定了几十种存在于接触部位的蛋白质:一些是衔接蛋白,但一些蛋白质并不是。Schuldiner指出,这些蛋白中的大多数都是完全未经研究的。他暗示这些蛋白质可能还有其它未被发现的作用。
2017年,De Camilli等人的研究强调了衔接点的一个新功能,并提示该功能对2型糖尿病的治疗有影响。该研究小组表明,参与胰岛素分泌的蛋白质可作为大鼠胰腺细胞中内质网和质膜之间的衔接蛋白。通过协调细胞器之间钙和脂质的运输,该蛋白有助于引发胰岛素的大量释放,这是防止血糖水平过高所必需的。
负面作用
Gökhan 是哈佛大学陈曾熙公共卫生学院(Harvard T. H. Chan School of Public Health)的代谢疾病研究员,他将内质网和线粒体之间的关系比作是动感的弗朗明哥舞蹈。Hotamışlıgil认为,就像舞者一样,细胞器接触并分开,然后再次接触,调一会情,然后一触即分。但是在患病的肝细胞中,两个细胞器会缠绕在一起,破坏舞蹈的节奏。
对此,他表示,这看起来并不优雅。Hotamışlıgil已经证明,小鼠肝细胞中内质网和线粒体之间的过度接触与胰岛素抵抗、糖尿病和肥胖有关。弗朗明哥舞蹈慢了就毫无美感。同样,病理情况下,线粒体-内质网连接点的物质运输节奏比较缓慢。
随着研究人员对接触部位的更多蛋白质进行分类,越来越多的研究指出了细胞器互作与其它疾病的关联。例如,线粒体融合蛋白2是内质网-线粒体连接中负责钙转运的衔接蛋白之一,在腓骨肌萎缩症(Charcot-Marie-Tooth病,一种罕见的退行性神经疾病)患者中该基因经常发生突变。VAPB是肌萎缩性侧索硬化遗传病的一种致病基因,其编码一种帮助将内质网锁定在几个细胞器上的蛋白质。
研究人员在阿尔茨海默病患者中发现了另一种与疾病相关的连接点。纽约哥伦比亚大学(Columbia University)的细胞生物学家Estela Area Gómez和Eric Schon已经证明,β-淀粉样蛋白前体蛋白的特定衍生物在受影响细胞的内质网表面积累。这种衍生物被称为C99,它触发了与附近线粒体的连接,从而使胆固醇运输失衡。
Area Gómez以小鼠和人类细胞系为模型,发现了由C99过度接触而产生的独特代谢物模式。她正在探索这些代谢物的血液检测是否可以识别阿尔茨海默病的亚细胞体征。
随着证据表明连接点影响健康和疾病中的细胞功能,一些研究人员已经开始讨论对细胞运输进行从头研究的必要性。Schuldiner指出,一个细胞器不能孤立地运作。 Lippincott-Schwartz看到了细胞生物学的一个令人兴奋的未来:细胞器—细胞器通信和耦合领域将揭示真正的基本过程。
但仍有技术细节需要解决。大多数研究都集中在内质网和其它细胞器之间的脂质或钙运输。现在的挑战是揭示在所有接触点上传输的所有信号。
美国马里兰州贝塞斯达国家糖尿病和消化和肾脏疾病研究所(US National Institute of Diabetes and Digestive and Kidney Diseases)的细胞生物学家Will Prinz指出,在某些方面,该领域有点太超前了。Prinz同意接触点是细胞生物学中一个重要的、几乎革命性的概念,但他认为有很多工作要做。对于细胞生物学,这真的是革命性的吗?他认为,现在还没到下定论的时候。
Voeltz则表示,至少有足够的证据表明,细胞器互作可以改变细胞生物学教科书。她举例,2015年最新修订的本科教科书中,关于细胞器和膜运输的描述还和20年前一样。 事实上,自1896年细胞学家Edmund Beecher Wilson将细胞器整齐地区分到各个细胞质区室后,教科书中关于细胞内部的描述就几乎没有变化。
从内质网到高尔基体到液泡再到内体,教科书中每个细胞器仍然是孤立的,而不是作为动态互作的整体。Voeltz指出,真实细胞并不是这样的,我们最好能更新这张经典的细胞结构图。
原文检索:
Elie Dolgin. (2019) How secret conversations inside cells are transforming biology. Nature, 567: 162-164.
张洁/编译