如何追踪肿瘤的代谢线索
 肿瘤细胞高度依赖糖类。它们以很快的速率消耗糖类,以支持其异常高的增殖速率。
肿瘤细胞高度依赖糖类。它们以很快的速率消耗糖类,以支持其异常高的增殖速率。
研究者结合多种技术,研究为什么癌细胞具有代谢灵活性。
窒息似乎是杀死肿瘤的好方法。但仅仅切断氧气供应并不能解决问题。来自威尔海姆生物学研究所(Kaiser Wilhelm Institute for Biology)的Otto Warburg等人曾在1927年指出,肿瘤细胞有两种供能来源,仅阻断其中一种,并不能杀死肿瘤细胞。如果想通过阻断能量供应来杀死细胞,就必须同时阻断有氧呼吸和糖酵解。
肿瘤细胞需要消耗大量糖类。正如Warburg等人所发现的那样,这种糖类的高消耗支持了肿瘤细胞的快速增殖。在健康的真核组织中,细胞将葡萄糖代谢为丙酮酸,然后代谢为乳酸,或者通过线粒体在氧气参与的情况下,进行有氧呼吸,将葡糖糖代谢成二氧化碳和水。癌细胞可以改变它们产生能量的方式:无论在有氧还是无氧条件下,肿瘤细胞都会“选择”将葡萄糖转化为丙酮酸,并避免线粒体氧化。这种特殊的代谢模式被称为Warburg效应。虽然Warburg效应大名鼎鼎,但至今仍未被完全破译。因此研究人员正在尝试采用新的多模式方法来研究这个问题。
乍一看,癌细胞选择代谢效率较低的模式来合成5'-三磷酸腺苷(5’-triphosphate(ATP))似乎非常奇怪。毕竟正如Matthew Vander Heiden、Lewis Cantley和Craig Thompson等人的研究所指出的那样,1分子的葡萄糖在无氧气条件下代谢成乳酸,只能生成2分子的ATP,而通过名为三羧酸循环(tricarboxylic acid cycle, TCA)的氧化磷酸化反应,1分子葡萄糖能合成36个ATP分子。因为研究人员认为,梳理代谢和癌症之间的联系“仍然是一个令人兴奋的研究领域”。癌细胞选择的代谢模式,虽然效率较低,但速度更快,并且能提供细胞快速增殖所需的蛋白质、脂质、核苷酸和其它大分子的构建模块。此外,葡萄糖还介导信号传导通路:3-磷酸肌醇激酶通路参与生长和增殖,并且经常在癌症中失调。
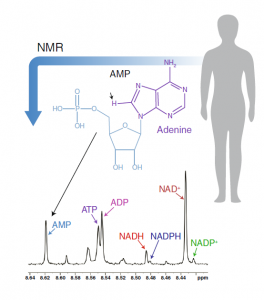
Raftery的实验室可以同时测量7种代谢辅酶。辅酶腺嘌呤成分中的H原子(箭头所示)是核磁共振监测的'指纹'。NMR核磁共振;Adenine 腺嘌呤。
肿瘤代谢特点
当研究人员Thompson和Ralph De Berardinis等人用13C核磁共振(nuclear magnetic resonance, NMR)光谱法追踪胶质母细胞瘤细胞的代谢时,他们发现这些细胞中的葡萄糖主要通过有氧糖酵解(有氧气的情况下,不进入线粒体,直接降解成乳酸)的方式进行代谢。他们发现,癌细胞的高谷氨酰胺代谢可以促进蛋白质和核苷酸的产生,并支持脂肪酸合成等生物合成途径。Daniel Raftery指出,深挖癌症的谷氨酰胺代谢是探索肿瘤代谢,并发现新的抗癌途径的一种方式。Raftery在华盛顿大学(University of Washington)有自己的代谢实验室,同时他也是弗雷德·哈金森癌症研究中心(Fred Hutchinson Cancer Research Center)的客座教授。他的团队研究了谷氨酰胺酶抑制剂双-2-(5-苯基乙酰氨基-1,3,4-噻二唑-2-基)乙基硫醚(bis-2-(5-phenylacetamido-1,3,4-thiadiazol-2-yl)ethyl sulfide, BPTES)如何通过影响代谢,影响各种乳腺癌细胞系。人乳腺癌细胞中的致癌基因MYC增加了谷氨酰胺酶的产生,而谷氨酰胺酶参与谷氨酰胺代谢。利用核磁共振光谱和15N-胆胺同位素标记,他们鉴定出了41种代谢物,其中许多参与葡萄糖和谷氨酰胺代谢,以及氨基酸合成。他们发现两种乳腺癌细胞系在接受BPTES处理后发生了明显的代谢物变化,揭示了BPTES可能能杀伤这两种肿瘤细胞。并且,Rafery发现,在正常和缺氧条件下,这一结论都成立。体内的癌细胞通常缺氧,这可能促使代谢从线粒体呼吸转向可实现更有利于增殖的途径。
Raftery表示,分析代谢物是一种评估癌症代谢变化、疾病发展或治疗效果的一种可行方法。目前,代谢组学与其它组学技术(基因组学、蛋白质组学和转录组学)一起,成为了常规检测手段。通过帮助跟踪生物系统的动态变化,代谢组学为其它组学做了补充。Raftery认为,代谢组学有可能提供更多的信息。基于质谱的血清分析可以鉴别癌症代谢特征。Raftery等人使用有针对性的液相色谱——串联质谱法,来比较结肠癌患者、结肠息肉患者和健康结肠人群的样本。他们研究了25种信号通路中的20种化学类代谢物,检测了158种目标代谢物中的113种,并发现每组患者的代谢特征存在显著差别。
Raftery指出,近年来,质谱法的发展速度比核磁共振法更快,且质谱应用范围更大,比核磁共振更灵敏,可以检测到更多的代谢物。但核磁共振在量化代谢物的精确度上更胜一筹。在示踪研究中,核磁共振在跟踪经过特异性标记的葡萄糖的代谢上非常有用。Raftery表示,核磁共振将告诉你哪个原子被标记。另外,他的团队开发了一种基于核磁共振的方法,可以同时测量7种代谢辅酶。为此,该团队还开发了一个核磁共振化学位移数据库,用于识别这些代谢物。
在他的核心实验室,Raftery团队帮助其他研究人员确定尽可能多的代谢物。他指出,目标不明确的代谢组学会带来诸多不确定性。许多检测到的代谢物可能是“兔子洞”:很难评估它们的生物学作用。你通常只能得到一系列的相关性。为了避免这种不确定性,他和他的团队开发了靶向测定:建立了一个包含来自55个代谢途径的300种水代谢物的列表。Raftery表示,尽管该列表并没有覆盖所有的代谢产物,但它涵盖了糖酵解、三羧酸循环、磷酸戊糖途径、氨基酸代谢和核苷酸合成的所有重要产物。
Raftery还表示,对于癌症,重要的代谢变化往往非常明显。例如,在脑癌中,诸如异柠檬酸脱氢酶(isocitrate dehydrogenase, IDH-1)之类的酶突变是常见的,并且存在易于识别的代谢物,例如2-羟基戊二酸里。然而,由于许多原因,糖酵解可能会发生变化,而这些变化需要代谢组学才能识别。研究癌细胞中微妙的代谢变化也具有挑战性。Raftery指出,虽然某些癌症中代谢变化是可测量的,并且可能是潜在靶点,但用潜在的抗癌药物实现部分代谢抑制也很困难。
Raftery认为,代谢组学的一大问题是质量控制,部分是由于缺乏标准化的样品制备方法。该领域的新成员对试验方案不太熟悉,他们可能无法控制或确保仪器运行良好。国家癌症研究所(National Cancer Institute, NCI)最近和学界以及工业界的同行携手组建的代谢组学质量保证和质量控制联盟(Metabolomics Quality Assurance and Quality Control Consortium)正在致力于解决质量问题,Raftery就是该联盟的一员。根据他的经验,核磁共振数据通常比质谱数据更容易重复。在Raftery看来,就全球分析而言,数据质量仍然存在问题,但针对性的代谢物标准谱一直在帮助提高实验室数据质量。
Raftery最后表示,除了开发代谢组学界的最佳研究方法外,该联盟正在研究一套用于测试仪器的参考样品,以解决全球液相色谱—质谱(LC-MS)数据的可重复性问题。NIST SRM 1950是现有的血液参考样品,但尿液不存在相应的参考样品。联合参考样本可能有用,例如含有300种代谢物的样品。如果这种联合参考样本运行良好,那么就可能实现真实样本的正确识别。
活细胞评估
为了评估活细胞的代谢状态,一些实验室可能会使用XF分析仪——一种由Seahorse Bioscience公司(2015年被Agilent Technologies公司收购)开发的,测量多孔板中线粒体呼吸和糖酵解速率的仪器。Agilent Technologies细胞分析部门开发市场战略的研究员、Seahorse前首席科学官David Ferrick指出,代谢是迄今为止测量和解释生物学的最佳分析手段,因为它是生物学的‘终点’(注:基因作用的结果是蛋白质,而蛋白质作用的结果是代谢)。他表示,癌症基因、代谢途径和信号传导奠定了基础,“而代谢则是直接发挥作用的那一环”。当Ferrick加入Seahorse时,他为代谢实验室推进了Analyzer的开发。当时,许多研究人员都试图在衰老、神经退行性疾病和糖尿病的背景下评估线粒体代谢。Ferrick认为,虽然包括Thompson在内的癌症研究人员正在“重塑Warburg假说”,但癌细胞代谢研究依然热门。XF Analyzer使用两种荧光团作为生物传感器:一种结合氧气,捕获线粒体呼吸的输出产物后荧光会淬灭;另一种结合质子,以跟踪糖酵解速率。尽管这两种荧光团均很常见,但它们很难被应用。Ferrick指出,我们需要将一些疏水的分子粘在一块塑料上,然后将其放入水介质中。把装有这些荧光团的测量皿放入到多孔板中,使其与细胞单层的距离在200微米以内,就可以用酶标仪检测读数,从而得到糖代谢相关数据。

David Ferrick认为,代谢是最适合监测和解读的生物指标。
在Agilent Technologies公司,Ferrick的同事Steven Fischer也是NCI代谢组学质量联盟的成员。他们经常讨论代谢研究。代谢组学分析可以帮助探索阻断恶性癌细胞生长的潜在机制。在Ferrick看来,“分子代谢组学可能是检测治疗效果的最佳办法。”但是使用代谢组学来比较癌细胞和健康细胞,“有时也会失效”。Ferrick还指出,随着测序和组学的发展,实验室发现了许多未知功能的基因,他们必须对其进行分析。他不看好这种“前向遗传学”方法,相反,他认为,实验室可以回归“反向遗传学”:从生物学开始,例如从代谢变化开始,探索这种变化的分子细节,一步步倒推,找到相关机制和基因。
Ferrick认为,单一方法只能让你看到部分细节。同一代谢物在不同肿瘤类型中可能参与不同活动,这意味着功能读数需要与分子细节相结合。他建议癌症代谢研究人员“不要局限于一种方法。”经过分子检测,实验室可能会探索功能,或者在代谢组学检测后,他们可能会进行细胞生物学实验。测序功能强大,但它意味着“未见果,先找因。”他希望实验室可以使用“以细胞为中心”的方法来整合基因组学、蛋白质组学和代谢结果。
他还表示,“以细胞为中心”的方法能帮助科研人员专注于他们“最擅长的检测分析”,同时可为他们提供癌症研究所需的分子、代谢和功能方面的信息。癌细胞具有代谢灵活性:它们代谢营养物质并迅速生长,改变自己生活的微环境,而微环境又反过来影响它们的病理。在整个疾病发生发展过程中,癌细胞都在不断适应,并维持平衡。癌症处于惊人的平衡状态。Ferrick很感兴趣的一个问题是“是什么让它们保持平衡?”
正确的食物
纪念斯隆凯特琳癌症中心(Memorial Sloan Kettering Cancer Center, MSKCC)的细胞生物学家和代谢研究员Lydia Finley指出,在组织培养中,任何快速生长的细胞都是高度耗糖的。癌症研究实验室的传统做法是在富含葡萄糖和谷氨酰胺的培养基中培养细胞。但Finley认为,目前还不清楚这两种营养成分是否是细胞培养所必需的。细胞“在解决代谢需求上的能力总是让她惊叹。它们非常聪明。如果给它们提供大量的葡萄糖,它们就会大量耗糖。在体内,癌细胞通常处于生理饥饿状态,这使得代谢研究人员难以决定如何给癌细胞提供营养,才能最接近真实状况。
洛克菲勒大学(Rockefeller University)研究员KivançBirsoy表示,在静态培养基中培养的癌细胞最终会经历葡萄糖缺乏,但生理情况下不会出现这种情况。作为怀特黑德生物医学研究所(Whitehead Institute for Biomedical Research)David Sabatini实验室的博士后研究员,Birsoy和当时的博士后生物工程师、现就职于纽约大学(New York University)的Richard Possemato合作开发了Nutrostat。在这种连续流动装置中,癌细胞在更贴近真实情况的低葡萄糖培养基中培养。该设备不断流入新培养基,并移除废物。Birsoy评估了商业上可获得的细胞培养基,例如RPMI培养基和DMEM培养基,并意识到这些培养基适合生长细胞,但不适合研究“真正的”癌细胞代谢。这种培养条件下,氧气、营养素和脂质都很充足。Birsoy指出,真正肿瘤中的癌细胞,它们暴露在更少的营养物质中,它们缺乏氧气,缺乏葡萄糖,更多种类的培养基配方才刚刚开始出现。
多模式研究
Birsoy的感觉是Whitehead Sabatini实验室是最早结合哺乳动物遗传学、基于CRISPR的遗传筛选和细胞代谢研究的实验室之一。Birsoy在此基础上,在洛克菲勒大学建立了自己的、以癌症为中心的实验室。他指出,由于他们是遗传学背景,因此他们根据遗传学得到的东西进行代谢组学研究。这项工作涉及人体细胞和小鼠、生化分析和靶向质谱分析。Birsoy等人做了很多CRISPR筛选,也做了大量的生物化学分析。虽然酵母研究长期以来一直利用遗传学研究代谢,但哺乳动物细胞领域缺乏相应的研究工具。基于CRISPR-Cas9的筛选使得遗传和代谢的融合成为可能。Birsoy等人使用shRNA筛选,并努力克服脱靶效应。CRISPR筛选能提供更强大的结果。工具开发还需要一段时间,因为在20世纪70年代和80年代高度活跃的代谢研究现在才刚刚复苏。
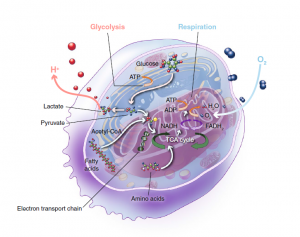
癌细胞很狡猾。在能量产生途径上,无论在有氧还是无氧情况下,它们通常“选择”将葡萄糖转化为丙酮酸,并避免线粒体氧化。Glycolysis:糖酵解;Respiration:呼吸;Glucose:葡萄糖;Lactate:乳酸;Pyruvate:丙酮酸;Fatty acids:脂肪酸;Amino acids:氨基酸;TCA cycle:三羧酸循环;Electron transport chain:电子传递链。
在Sabatini实验室,Birsoy使用Nutrostat来研究低糖条件下不同类型的患者来源的癌细胞的代谢情况。他们进行了遗传筛选,并应用慢病毒DNA条形码来标记和跟踪细胞。细胞开始更依赖线粒体氧化磷酸化(oxidative phosphorylation, OXPHOS)来产生能量。该团队研究了哪些线粒体突变对癌细胞的影响最大,从而揭示了最易受到OXPHOS抑制剂影响的癌细胞类型。使用DNA条形码和Nutrostat,他的团队最近研究了一种不能自己合成胆固醇的癌细胞(大部分癌细胞都能自己合成胆固醇)。在罕见且侵袭性较强的间变性大细胞淋巴瘤中,细胞从自身环境的脂蛋白中吸取胆固醇。使用基于CRISPR-Cas9的筛选、细胞条形码和代谢物分析等技术,Birsoy的团队发现,这种癌细胞中参与胆固醇摄取途径的LDL受体发生了突变。他们还研究了该途径的生化中间体。该细胞无法表达胆固醇合成途径中一种重要的酶,从而导致该酶的底物角鲨烯在胞内大量积累。
胆固醇合成能力的丧失使Birsoy感到好奇。似乎角鲨烯具有抗氧化特性,可以把这种合成缺陷变成一种生存优势。除此之外,Birsoy还探索了多种癌症类型和肿瘤内代谢异质性。Birsoy的目标是,未来人们可以根据代谢特征来辨别癌症。他指出,少数癌症类型,例如他最近研究的淋巴瘤,存在特定的代谢脆弱性。但他不认为所有癌症都存在普遍的代谢脆弱性。
Birsoy现在正在使用Nutrostat来表征癌细胞对其它营养素(如谷氨酰胺)的使用。他表示,这种氨基酸在蛋白质合成中起着重要作用,并以一定的方式进入TCA循环,使其几乎与葡萄糖一样具有代谢重要性。Birsoy认为,一个困扰癌症研究的错误观念是癌细胞因线粒体受损而使用大量葡萄糖。将这个概念反过来可能才是正确的:癌细胞也可能更依赖于线粒体,并根据需要切换到OXPHOS代谢途径。癌细胞利用线粒体来生存。
在实验方面,他使用了XF Analyzer,结果发现这些仪器有助于探索哪些代谢途径受到了干扰。这些发现需要对代谢分析和示踪实验进行跟踪,以追踪代谢物的去向。Birsoy希望开发新型生物传感器,以提供细胞代谢物的功能信息和定量信息。他表示,这是一个非常不发达的领域。与转录组学等其它组学技术一样,质谱可以提供海量数据。Birsoy的研究方向始于关注特定代谢方面或途径,而不是列出所有细胞可能的代谢物。这就是Birsoy喜欢遗传的原因。他认为,无论是在癌细胞上,还是健康细胞上,针对某个基因,然后使用代谢组学工具追踪这一途径,通常会得到不错的发现。
干细胞,癌细胞
在自己位于MSKCC的专注于代谢研究的实验室里,Finley将一半的人力用于研究干细胞,另一半则用于研究癌细胞。她认为,这两种高增殖细胞在代谢上有很多共同之处。相比于癌细胞代谢,关注干细胞代谢的科学研究很少。但Finley推测干细胞的功能和代谢可塑性是相互关联的。
在研究代谢时,实验室可能会试图检测给定细胞的所有代谢物,但她认为这在很多情况下毫无意义。例如,敲除糖酵解途径中某个酶,并且想要找到被影响的代谢途径和影响方式时,检测所有产物是有用的。但是,在KRAS突变体与KRAS-野生型细胞的比较中,或者用核磁共振或质谱检测患者接受酪氨酸激酶受体抑制剂治疗后的癌细胞代谢变化时,代谢物本身并不能提供想要的信息。

Kivanc Birsoy指出,可以根据代谢特性辨别肿瘤细胞。
当代谢物的变化与前次实验中的结果不同时,Finley实验室的成员会感到不安。此时Finley会要求他们研究代谢变化的模式:一般来说,两次实验中受干扰的途径是否相同?变化趋势是否相同?她建议,只需关注趋势,无需关注具体的幅度,比如上次实验增加了1.5倍,这次却增加了3倍。如果相同的代谢物增加或减少,则表明整体扰动和代谢转变。哪怕两次实验的操作有些许差异,也可能得到跳动的数据。因此,需要关注的是趋势,而不是具体的幅度。
Finley表示,当看到较高水平的TCA中间体,可能会得出细胞有氧代谢较强的假设,表明OXPHOS对细胞的存活更为重要。她们可以进一步测试这个假说。Finley认为,研究代谢是“了解细胞需要干什么的第一步”。在不同的培养基中评估细胞,得到的答案可能不同,因为细胞会根据营养条件,调整自己的代谢模式。当她和她的团队测量TCA代谢物时,只有在预测到特定途径变化时,高水平的α-酮戊二酸才有意义。鉴于此,她认为,她们可以根据代谢产物来提出假说。
Finley建议生物学研究者在自己的研究中整合代谢组学工具。她的实验室并不偏爱任何一种技术——无论是核磁共振、质谱或遗传工具。相反,她倾向于将多种技术的结果与基于细胞生物学的数据结合起来,以了解代谢如何影响细胞。专注于某类代谢物的实验室可能具有技术偏好,因为某一技术可能最适合用于测量该代谢物。但是,在全面观察细胞如何解决问题时,Finley的方法就是“研究细胞本身。”许多变量决定了细胞代谢研究,例如细胞在培养皿上和培养基中生长的时间等,都可能导致实验性的再现性问题。Finley提醒,在遗传学中,基因表达是“静态特性”,因为蛋白质合成是可以检测的。但在代谢研究中,重复性是个大问题。代谢变化如此之快,你必须关注整体的代谢模式。
未来代谢学
Raftery表示,代谢组学仍然急需一些新方法,例如,实验室在评估代谢途径和设计新实验时,希望将代谢结果与基因组或蛋白质组学的数据联系起来。他指出,数据集成仍然具有挑战性。当组学数据和目标代谢组数据都很稀缺时,数据本身就是一个问题。获得足够的数据重叠来产生标准数据非常困难。
实验室可能会在调查早期选择进行代谢分析,以选择将发现与代谢途径信息和突变数据联系起来的实验方法。他们可以使用Agilent的分析仪进行活细胞代谢评估。Raftery认为这是非常好的第一步。在了解了样品的线粒体性能后,研究人员可以进一步追踪葡萄糖的去向,看看哪些途径受到影响并进行代谢分析。这个时候就需要用到Raftery等人的仪器了。
随着肿瘤在体内生长,肿瘤内的区域会出现不同的代谢特征,肿瘤的代谢也会改变其微环境。研究人员需要工具来研究与癌症和干细胞相关的这种异质性。Finley表示,干细胞微环境中的缺氧可能会加强某些代谢途径,这种代谢转化对于其维持干性(分化能力)具有重要影响。
Birsoy指出,他的癌症遗传学同事越来越认识到癌症代谢的作用。代谢研究尚未转化为临床治疗方法,但他认为未来会成为现实,并且代谢研究将继续发展和成熟。他还认为,癌细胞代谢研究将产生关于癌症生物学、代谢紊乱和健康细胞代谢的新见解。正如Finley 所想,接下来,他们有的忙了。要研究的东西太多了。
原文检索:
Vivien Marx. (2019) How to follow metabolic clues to find cancer’s Achilles heel. Nature Methods, 6: 221-224.
张洁/编译




