核转运与神经元的那些事儿
细胞核物质转运失调可能引起神经元死亡。
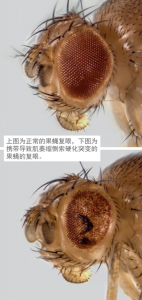
普通果蝇的复眼通常是砖红色的。但在约翰霍普金斯大学医学院(Johns Hopkins University School of Medicine)神经学家Tom Lloyd的实验室中,许多果蝇的眼睛里有黑色或白色的斑点,这标志着组成复眼的800个神经元正在萎缩和死亡。
这些果蝇携带了肌萎缩侧索硬化症(amyotrophic lateral sclerosis, ALS)的致病基因。ALS是一种神经退行性疾病,也被称为Lou Gehrig病。通过观察果蝇的眼睛,研究人员能快速评估疾病进程。通过测量每只昆虫眼睛的损伤程度,研究人员可以快速判断药物、基因改造或其它一些治疗干预是否有助于阻止神经元丢失。
这些眼睛也为ALS的核心问题提供了答案:那些杀死神经元的东西最终杀死了病人。
40%的具有ALS家族病史的病人携带这些果蝇所携带的突变,10%的散发病例携带这种突变。该突变只有6个碱基长,位于一个名为C9orf72、由数百或数千个短DNA序列的额外拷贝组成的基因中。该突变会导致细胞合成异常大的RNA链,这些RNA会缠绕在细胞核中的数百种蛋白质上,使它们失活。Lloyd和同事Jeffrey Rothstein假设,这些RNA导致的某些蛋白质失活可能是ALS的发病关键。
几个月来,研究人员通过构建携带ALS突变和每种蛋白质基因的失活或过度激活的果蝇菌株,系统地研究了每种蛋白质的作用。一组RanGAP蛋白质水平升高的果蝇从众多组别中脱颖而出。这组果蝇破蛹15天后,眼睛仍然是纯粹的砖红色。Lloyd表示,RanGAP是迄今为止最有效的神经变性抑制因子。根据已有的研究,RanGAP可以作为运载体,介导其它蛋白质在细胞核和细胞质之间的转运。
该团队的结果颠覆了神经科学家对肌萎缩侧索硬化和脑部疾病的理解,同时很多其他团队的研究也得到了类似的结果。2015年,另外两个研究小组报告说,细胞核运输系统的缺陷不仅是ALS的标志性特征,也是额颞叶痴呆(frontotemporal dementia, FTD)——另一种由C9orf72突变引起的神经退行性疾病——的元凶。科学家很快就会将核分裂中的功能失调与其它神经退行性疾病——阿尔茨海默病、亨廷顿病和脊髓小脑性共济失调——甚至正常衰老联系起来。在所有这些疾病中,突变引发的蛋白质异常堆积在某种程度上是神经元杀手。
约翰霍普金斯脑科学研究所(Johns Hopkins Brain Science Institute)的神经学家Rothstein指出,当一个团队做出了一个发现,然后试图用它解释其它各种疾病时,他常常感到不安。但是,核转移功能的异常似乎确实是各种大脑疾病的关键。
这些发现具有重要的学术意义,有助于推动攻克与年龄相关的神经退行性疾病——一个使药物开发商望而却步的目标。密歇根大学(University of Michigan)安娜堡分校的神经学家Sami Barmada表示,如果核转运的功能失调是老化大脑的一个保守特征,那么恢复神经元的核转运可能是一种非常广泛而有效的治疗方法。
一些生物技术公司抓住了这一商机,在动物模型中探索这一想法的可行性,并计划今年开展首次人体试验。其中最主要的是:位于马萨诸塞州剑桥的Biogen公司于2018年购买了一种靶向核转运、名为KPT-350的化合物的开发权。目前该药物的作用机制的研究还比较少。但是,Biogen的神经肌肉和运动障碍研究主管Chris Henderson指出,从生物学原理角度上来讲,KPT-350是没有问题的。这是一种具有理论基础的药物,他们对它的临床试验持乐观态度。
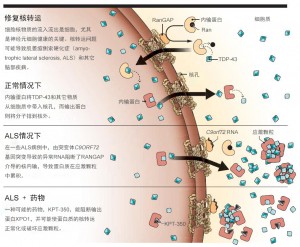
包裹细胞核,并将其与细胞质分隔开来的脂质膜就像是忙于双向运输的“国际边界线”。例如,DNA结合蛋白和其它分子不断地流入细胞核以帮助打开和关闭基因。这些基因产生的信使RNA以另一种方式流出到细胞质中的蛋白质组装平台。细胞通过调节核孔来调节核转运。一旦核转运受阻,细胞功能就会受损。
2010年,伦敦国王学院(King's College London)的研究人员以人类神经癌细胞为模型,实验性地阻断了参与核转运的蛋白质。结果这些细胞就和ALS患者的细胞一样:细胞质中积聚了一种名为TDP-43的蛋白质团块。
这一早期报告并未受到ALS研究领域的重视。ALS患者细胞内的核转运机制尚不清楚,研究人员也无法确定TDP-43-a蛋白质(一种通常与细胞核中DNA和RNA结合,调节基因表达的多个步骤的蛋白)在细胞质中的积聚是杀死神经元的因,还是只是不同毒性过程的果。解答这一问题花了5年——Lloyd和Rothstein对果蝇眼睛的研究,突出了核转运在ALS中的重要性。
霍普金斯团队的结果令人振奋,因为该团队已经确定了RanGAP(一种转运蛋白)是神经变性的关键。ALS的果蝇模型和人类患者的细胞都表明,突变体C9orf72基因产生的长RNA似乎会粘附在核孔附近的RanGAP上,并使其失活。丧失功能的RanGAP刺激了核转入系统,导致蛋白质在细胞质中的积累,例如TDP-43在胞质中的大量聚集。
另一项令人振奋的研究是关于一个潜在药物在果蝇上的良好治疗效果。德国路德维希马克西米利安大学(Ludwig Maximilian University)的生物化学家Dorothee Dormann表示,突然间,他们找到了一种潜在的治疗方法。
该团队的药物并不能提高细胞质中RanGAP的水平,因此不能恢复核内流,从而防止神经元死亡。但Lloyd认为,阻断TDP-43和其它核蛋白的流出可能会产生同样的有益效果。已知一种名为KPT-276的实验化合物能选择性地抑制一种关键的核输出蛋白——输出蛋白1(XPO1)。这种做法是在核内流错误的情况下,扰乱核外流,结果相当有效。 当Lloyd给果蝇施用KPT-276时,果蝇的复眼始终保持着漂亮的砖红色——神经元的死亡被阻止了!
KPT是马萨诸塞州牛顿市一家小型制药公司Karyopharm Therapeutics给一系列实验化合物的命名。Karyopharm于2008年成立,用于开发治疗癌症的XPO1抑制剂,其目的是引发肿瘤抑制蛋白在细胞核中的积累,从而实现抗癌功能。目前,该公司的第一个临床候选药物——一种治疗多发性骨髓瘤的药物,有望在未来几个月内获批上市。
Karyopharm的化学家开发了一系列XPO1抑制剂,包括KPT-276和一种名为KPT-350的类似物。这两个抑制剂具有一个重要的优势:它们比其它候选分子更容易穿过血脑屏障。KPT-350在临床前测试中被证明更有效,且毒性更低,因此该公司正在挖掘KPT-350在治疗大脑疾病和损伤上的潜力。
Lloyd和Rothstein的研究结果激起了Karyopharm公司的兴趣。当Karyopharm神经退行性疾病和传染病部门负责人Sharon Tamir得知霍普金斯研究人员正在使用KPT-276,而不是KPT-350进行研究时,她给他们打了电话,提出可以用效果更好的KPT-350,并希望就此达成合作。与此同时,她开始向日本、比利时和美国的其他研究团体分发KPT-350。总的来说,这些科学家证实了,在ALS、亨廷顿和其它脑部疾病的一系列人类细胞、果蝇和啮齿动物模型上,该药物具有良好的神经保护作用。
例如,西奈山伊坎医学院(Icahn School of Medicine)的神经科学家Jeffery Haines的团队的研究显示,KPT-350治疗有效地维持了轴突(神经元用于传递信号的一条长突起)的健康,并改善了具有多发性硬化症状的小鼠的运动功能。而霍普金斯小组的研究则表明,该药物能增加携带亨廷顿病致病突变的小鼠的神经元的存活率。
Ravstein实验室的前博士后Gavin Daigle指出,还有很多东西需要探索,例如为什么不同大脑区域、不同类型神经元中的核孔复合物都容易发生功能失调,从而导致多种不同的疾病。在加入剑桥的AbbVie公司之前,Daigle的项目是研究核孔功能失调和阿尔茨海默症之间的关联。但他强调,所有的研究都表明了一件事:核运输可能是治疗大脑疾病的靶标。
基于这些结果,Biogen从Karyopharm公司购买了在人体上测试KPT-350的专利。 Biogen的KPT-350研发项目负责人Laura Fanning表示(该公司将KPT-350重新命名为BIIB100分子),Karyopharm积累的临床前数据确实令人兴奋。KPT-350不仅在小鼠模型上有效。证据基础非常广泛。KPT-350的首次人体剂量递增研究可能在今年晚些时候在ALS患者身上展开。Henderson指出,如果该药物显示出对ALS的疗效,Biogen可能会将其临床试验扩展到其它大脑疾病上。
虽然KPT-350似乎在实验室中起作用,但具体机制尚不明确。现就职于纽约Regeneron制药公司的Haines指出,随着更多数据的出现,故事开始变得越发模糊。最初,大多数科学家认为,KPT-350通过阻断XPO1,使TDP-43等蛋白质滞留在细胞核中,从而阻止了其在细胞质中的聚集。但去年,Dormann的团队和德克萨斯大学西南医学中心(University of Texas Southwestern Medical Center)生物化学家Philip Thomas领导的研究小组分别报道,TDP-43和另一种名为FUS的蛋白质似乎通过被动扩散,而非XPO1介导运输,流出细胞核。(在一些ALS或FTD患者中,FUS也会在运动神经元的细胞质中聚集。)
因此,如果KPT-350没有直接作用于运输系统,那么它的作用机制是什么?Dormann认为,看起来药物的目标是一些更普遍的神经毒性途径,但有待澄清的是,药物的作用机制是什么,以及药物到底纠正了核转运的什么缺陷。
最近的研究表明,一种可能性是药物实际上是靶向在细胞应激期间形成的微小、密集的蛋白质和RNA包。在健康细胞中,病毒感染、热休克或其它一些刺激因素存在情况下产生的那些无膜“应激颗粒”通常会在刺激因素被清除后分解。在ALS或FTD患者的神经元中则不是这样。在这些细胞中,应激颗粒持续存在,并变粘,不断积累TDP-43和FUS等蛋白质,最终转化为固态、有毒的聚集体。
在过去一年中,一些研究小组已经表明,核运输复合体的组成部分——包括内输载体、输出载体和核孔本身的某些部分——可能与胞质中的这些蛋白聚集体发生相互作用。运输系统失调,导致更多的TDP-43和其它蛋白质被添加到应力颗粒中,形成负反馈,进一步导致核转运阻滞。梅奥诊所(Mayo Clinic)的神经科学家Wilfried Rossoll表示,TDP-43不仅仅是核质转运缺陷的果,也是一个因。
2018年8月,来自比利时鲁汶天主教大学(Catholic University of Leuven)的神经生物学家Ludo Van Den Bosch团队的研究结果表明,转运蛋白XPO1本身可能在应激颗粒中发挥作用。这意味着像KPT-350这样的药物可能主要用作应力颗粒破坏剂,对核转运的任何影响都可能是次要的。与Karyopharm合作的Van Den Bosch指出,事情比最初想的复杂得多。
KPT-350的机制不明问题并没有阻止其他团体采取其它策略来解决核转运问题。例如,2017年,英国谢菲尔德大学(University of Sheffield)的Guillaume Hautbergue等人的研究结果提示,携带C9orf72突变的果蝇可能存在另一种导致神经元死亡的核输出缺陷。Hautbergue正在研究如何靶向该蛋白质,以防止异常RNA的外流。
其他研究人员正致力于破坏应激颗粒。宾夕法尼亚大学(University of Pennsylvania)的蛋白质生物化学家James Shorter解释,这种方法能激活转运蛋白,释放应激颗粒中裹挟的核孔蛋白,使它们能够回到细胞中的常规位置。他正在开发一种方法,为细胞转入一个产生“解聚酶”蛋白的基因,并开始在ALS的小鼠模型中测试这一治疗策略。
一些制药公司,包括加州南旧金山的Denali Therapeutics和剑桥的Aquinnah Pharmaceuticals都在寻找可以达到相同效果的小分子。Aquinnah联合创始人兼波士顿大学医学院(Boston University's School of Medicine)神经药理学家Ben Wolozin表示,这些疗法可能无法直接针对核运输途径,但它们可以产生一定效果,因为破坏应激颗粒有助于恢复核运输功能。对此,Wolozin指出,这是综合生物反应的一部分。
Aquinnah希望今年开始在ALS患者中评估一种先导化合物的效果,该试验与Biogen的KPT-350临床试验的启动时间比较接近。目前,Biogen的科学家仍在试图确定这种药物在该疾病的各种遗传模型(包括上述提到的果蝇)中的作用。但在某种程度上,Henderson认为,了解确切的作用机制并不重要。重要的实验是在人类患者身上测试效果。
原文检索:
Elie Dolgin. (2019) The brain's traffic problems. Science, 363:221-223.
张洁/编译