改变阿尔茨海默症的病程
阿尔茨海默病(Alzheimer's disease, AD)是一种进行性、不可逆转的神经退行性疾病,估计占所有痴呆病例的60%至80%。
阿尔茨海默病的巨大疾病负担
阿尔茨海默病(Alzheimer's disease, AD)是一种进行性和不可逆的神经退行性疾病,估计占所有痴呆病例的60%至80%。科学家们已确认,β淀粉样蛋白(amyloid beta,Aβ)聚集形成斑块,含有tau蛋白的神经原纤维缠结,以及神经元的退化是AD疾病发生发展的关键过程。阿尔茨海默病是一个连续的病理生理学过程,在临床症状出现前的数十年,人脑就已产生AD特异性的病理学改变。全世界大约有5000万人患有痴呆症,这个数字预计每20年几乎翻一番。 大部分新发生的病例都来自低收入和中等收入国家,因为这些国家的老龄化比发达国家更严重。随着人口老龄化和预期寿命的增加,预计AD的发病率还会增加。
由于患病人数多,且疾病发展缓慢,AD有很高的经济和社会负担。痴呆症护理的成本正在上升,到2030年预计全球痴呆症的经济负担将增加到2万亿美元。虽然改善AD痴呆症状的治疗已有20多年的历史,但目前尚无治愈AD的方法。目前的治疗都无法影响AD的潜在病理,不能延缓发作或减缓疾病进展。据估计,将AD痴呆症的发病时间延迟五年到2050年将使经济负担减少36%。尽管AD疗法的开发遭遇了许多挫折,但许多专家认为在不久的将来,能开发出真正有效的AD疗法。Biogen(百健艾迪)和Eisai(卫材)以及阿尔茨海默氏症的学术和行业研究人员共同致力于将这一希望变为现实。
图1 根据淀粉样蛋白假说,阿尔茨海默病的病理在临床症状出现前的数十年就发生了。
淀粉样蛋白假说
淀粉样蛋白假说仍然是在临床研究中描述AD的主要框架,并且继续影响AD潜在治疗的开发。根据淀粉样蛋白假说,Aβ是AD病理学的主要驱动因素,会导致淀粉样蛋白斑块的形成、神经原纤维缠结、突触功能障碍、神经变性,以及随后的认知障碍和临床痴呆。有证据表明Aβ的异常积聚可能在临床痴呆发病前20年就开始了。尽管包括人类家族遗传学在内的大量证据支持这种疾病机制,但需要继续进行调查以验证和完善这一假设。
过量产生和不充分清除之间的不平衡可导致Aβ肽以淀粉样斑块的形式在脑中积累和聚集。因此,用于治疗AD的淀粉样蛋白靶向治疗方法主要旨在通过抑制产生和聚集或促进清除来降低脑内的Aβ(参见图1)。在过去的几十年中,多种Aβ靶向疗法经过了临床试验的测试。虽然没有一项试验符合其主要终点,但这些试验大大增加了我们对AD和Aβ的作用的理解。成熟的结果解读揭示了为什么早期试验会以失败告终。这些教训,加上正在进行的队列研究中获得的知识,影响了新化合物和试验的合理设计。试验设计的改进——例如临床试验招募疾病更早期的患者,根据Aβ病理选择患者,目标的严格评估,以及有意义的试验终点的使用——将有助于更严格地测试基于淀粉样蛋白假说的靶向药物试验。
来自临床试验的事后汇总分析的结果提示,抗淀粉样蛋白治疗可能对处于AD疾病更早期阶段,且接受更高剂量治疗的患者有益。结合最近有希望的试验结果,这些数据为在临床试验环境中持续探索淀粉样蛋白假说提供了理论依据。
早期诊断和干预的重要性
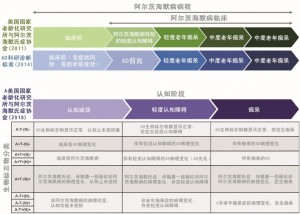
有一种误解,认为只有年纪大的人才会受到AD的影响。实际上,AD的临床症状可以在诊断为痴呆之前数年开始微妙变化,其中一些症状甚至被认为是正常衰老的症状。然而,AD作为一个缓慢发生的疾病,一些病人AD生物标志物检测为阳性,但无症状,另一些病人由于AD发生了严重痴呆(图2)。相当多的研究旨在确定和验证AD的生物标志物,这些生物标志物可以在临床症状出现之前或开始时预测病理学的存在。由于轻度认知功能障碍可能是由AD以外的许多潜在生物和医学状况引起的(如脑血管疾病或路易体痴呆),及时准确的病因诊断对于个性化的患者管理至关重要,比如参与到合适的临床试验中。
不断发展的诊断框架,如国家老龄化研究所和阿尔茨海默氏病协会(Aging and the Alzheimer's Association,NIA-AA)和国际工作组(International Working Group,IWG)诊断标准,将生物标志物与临床标准结合使用,用以准确诊断AD引起的轻度认知功能障碍。此外,在科研用的NIA-AA新诊断框架中,使用潜在病理学的生物标志物来定义AD的临床分期,让AD变成一个根据病理学定义、可以在症状发生之前进行诊断的疾病。在新的研究框架中,除了对认知症状的评估之外,还使用生物标志物谱,以评估淀粉样蛋白病理学(A +/-),病理性tau(T +/-)和神经变性(N +/-)的程度。因此,该研究框架旨在用详细和离散的方式表征疾病以减少异质性,进而从临床试验和临床数据中获得更深的见解。目前,虽然生物标志物测试可用于研究环境,但在临床实践中并不容易获得。在考虑将生物标志物的使用扩展到常规临床试验时,诸如对报销和基础设施的潜在限制等挑战仍然存在。因此,临床试验在验证可能对常规临床诊断有用的候选生物标志物上非常有用。因为疾病病理学在症状出现之前很久就开始了,所以早期干预被认为是最有希望的,可能影响潜在病理生理学并延迟AD症状和进展的方法。
然而,即使在没有疾病改善疗法的情况下,临床试验也可以帮助人们获得及时准确的诊断。人们普遍认为,通过生物标志物对AD进行早期准确诊断可以减少医疗支出。多项研究证实了早期诊断的经济效益,其中一项证据来自阿尔茨海默氏症协会(Alzheimer’s Association)。该报告指出,在美国,在轻度认知障碍阶段而非痴呆阶段识别AD可能节省7.9万亿美元。早期干预允许患者进行生活方式调整,有助于保持认知功能。此外,可以通过定期体检密切跟踪患者的疾病进展,可能鼓励其参与临床试验。此外,在AD早期获得确诊的患者能更珍惜和享受与亲友在一起的时光,同时尽早规划日后的护理和财务问题。
图2 确定阿尔茨海默症疾病阶段的框架。
诊断难题
尽管公众也意识到了早期和准确诊断的重要性,但目前的医疗保健系统使得AD的早期诊断难以实现。早期认知症状很容易被忽略,并且全科医生可能不会主动评估认知功能,导致患者多次转诊却未确诊。造成这些低效率的潜在障碍包括误诊,专家数量有限,披露诊断的不确定性以及医保覆盖率低。
对患者的挑战可能包括焦虑,以及因为AD没有有效治疗而不愿意去检查是否患了AD。除了当前的挑战之外,一旦有了可以改善AD的疗法,庞大的病人群体将对当前的医疗保健系统造成巨大的压力。
基础设施障碍包括培训足够数量的阿尔茨海默病专家,可用的临床生物标志物的缺乏,以及难以对“有风险”的人群(根据他们的年龄、家族史和主观投诉)进行大规模筛查。
未来的医疗保健模式将需要跨学科护理团队、患者和护理人员之间的有效合作,以提供最佳的患者管理。尽管新疗法的诞生会推动医保系统的变革,但目前通过增加关于早期发现和诊断的益处的宣教,并为医疗服务提供者制定明确的指导方针,有助于改善和简化这一变革过程。
临床试验的重要性
截至2017年,共有105种AD药物正在进行临床试验,其中70%的药物作为AD的潜在疾病修复疗法进行测试,其中18种进入了临床III期。完成正在进行的AD试验所需的参与者人数超过5万位。为AD临床试验招募足够个体的能力是药物开发面临的重大挑战。由于临床试验研究评估旨在预防或减缓AD的疗法,并评估这些潜在治疗的益处和风险,因此必须改进临床试验设计,包括纳入更合适的终点以减少样本量和研究持续时间。除了可能发现新的治疗方法之外,患者参与临床试验的好处包括:获得疾病教育,获得高质量护理,密切监测健康和疾病管理。
受患者、患者家属、医护人员以及社会的巨大需求的激励,我们并没有因为AD药物研发的屡战屡败而踟蹰不前。作为我们继续研究和帮助那些受AD影响的人的承诺的一部分,Biogen和Eisai建立了合作伙伴关系,研究针对疾病早期多种已知AD原因的研究性治疗方法。作为该研究合作的一部分,除了正在进行的针对BAN2401候选药物的2期临床试验(NCT01767311)之外,我们已经将两种疗法推进到临床III期,目前正在招募患者以测试aducanumab(NCT02477800 / NCT02484547)和elenbecestat(NCT02956486 / NCT03036280)的疗效。
Biogen(www.plangen.com)和Eisai(www.eisai.com)都拥有强大而多样化的药物组合,其中多个药物处于不同的发展阶段。
展望未来
尽管多年的研究为AD的病理学提供了有价值的见解,但挑战仍然存在:(1)开发和测试改变AD疾病过程的疗法;(2)优化的诊断和治疗体验。AD社区内的合作,包括公共和私营伙伴关系,学术界,工业界和监管机构的合作,是极其重要的,并将继续推动这一领域的发展。 作为一个机体,我们致力于共同优化患者管理,充分了解AD的科学基础,并开发有效的、可以影响疾病进展的治疗方法。
原文检索:
Ivana Rubino, Chad J. Swanson, Bruce Albala, Samantha Budd Haeberlein, Johan Luthman & Philipp von Rosenstiel. (2018) Modifying the course of Alzheimer’s disease: Biogen and Eisai perspectives. Nature.
张洁/编译