类器官:更好的体外模型
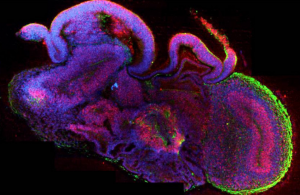
人类脑部类器官显示出了非常复杂的构造。
3D人类细胞培养物改变了科学家模拟器官发育和功能的方式,但这些类器官本身也非常复杂。
25年前,美国劳伦斯伯克利国家实验室分子生物学部门(Lawrence Berkeley National Laboratory's Division of Cell and Molecular Biology)的研究者Mina Bissell注意到了一些奇特的现象:她在培养皿平面培养的小鼠乳腺细胞出现了异常的行为。
最明显的是,这些细胞没有分泌乳汁——乳腺组织的特征。她认为,这可能是异常的细胞组织方式导致了细胞的异常表现。所以,她把细胞扩增后,将其植入细胞外基质溶液中——类似体内细胞所处的环境。
结果她发现,在这种情况下,这些乳腺细胞会形成3D结构,并且再度产生乳汁。她据此得出结论,细胞的行为很大程度上取决于胞外环境。Bissell表示,在2D中,细胞不仅会丢失组织结构,还会受伤。
Bissell在乳腺组织上的工作是3D上皮细胞培养领域的一些探索性工作。现在3D上皮细胞培养通常被称为类器官。这几年,许多科学家已经开始研发小鼠和人类细胞的3D模型。无论是来自成年人、胚胎的干细胞,还是诱导多潜能性干细胞(induced pluripotent stem cell, iPSC)都可以被用来创建肠道、肝脏、胃,甚至大脑等器官的模型。
与2D培养物和体内动物模型相比,这些3D培养物具有诸多优点。平铺于培养皿时,这些细胞的行为会与在体内时不同;虽然体内模型更贴近真实情况,但由于小鼠、猴子和其它动物不是人类,因此不能充分反映人体情况。事实上,要将这些动物模型的结果转化为对人体器官的机制的理解并不容易。使用胚胎干细胞产生前列腺组织的伊利诺伊大学医学院(University of Illinois College of Medicine)的研究人员Gail Prins指出,但类器官就不一样,你可以在体外模型中回答体内模型无法解答的问题。
衍生自胚胎干细胞的类器官使科学家能够研究子宫内的发育过程,iPSC和成体组织来源的组织细胞可以研究实际患者的细胞特异性。在某些情况下,类器官可用于检验某种治疗手段是否适用于罕见疾病。
但是就像任何模型一样,类器官也不完美,它也有局限性。例如,它们是非血管化的,并且缺乏通常构成给定器官的多种细胞类型。科学家正在推进这些3D模型,他们希望改进培养基配方,仅对特定的器官区域建模,或者构建不同的类器官,然后将它们组装起来。
疾病和发育模型
在Bissell开始建立3D乳房细胞模型之后不久,荷兰Hubrecht研究所的一名医师和分子遗传学家Hans Clevers开始使用成体干细胞来构建小肠组织类器官。
他的团队首先采用来自小鼠的干细胞构建这些类器官,随后继续构建人类类器官。2009年,Clevers团队发表了他们的第一项成果,表明他们能够在实验室培养出肠组织。从那以后,他们陆续构建了肝、胃、肺、前列腺——除了骨髓和心脏之外的各种类器官(心脏和骨髓只能由胚胎干细胞产生)。这些类器官由健康组织构成,也就是说,活体动物可以接受这些类器官移植。Clevers表示,如果你将细胞培养物回植进小鼠体内,小鼠就会得肿瘤;但如果将他们构建的类器官移植到小鼠身上,小鼠就一切正常。
我们很难通过疾病模型,尤其是传统的2D培养物来确定细胞异常究竟是由遗传学,还是环境因素引起的。而类器官不仅是3D的,而且还可以衍生自患者的体细胞。Clevers和实验室的其他成员从病人身上提取上皮细胞来研究特定的病理状况,并查看不同类型的药物是否可用来治疗这些病变。他指出,他们可以很轻松地就获得一些肺部样本,并且一周左右便可以获得可在实验室培养的组织。
Clever实验室的工作焦点之一是使用囊性纤维化患者的细胞构建肠道类器官。囊性纤维化可由多种遗传突变引起,从而导致一种主要在肺和肠道中表达的蛋白发生突变。目前已有相应的药物可以治疗常见突变引起的囊性纤维化。Clevers的小组使用患者的细胞培养出肠组织,然后检测这些组织是否对实验性药物作出响应;只有响应出现,患者才能接受相应的治疗。到目前为止,Clevers的小组已经通过这种方式帮助7名患者筛选出合适的药物。
Clevers的实验室设计了可以促进类器官生长、并维持其在培养皿中的活力的化学成分。通常,到了分裂次数上限,细胞就会停止增殖。但是,只要保持适当的营养,Clevers的类器官就可以一直保持活力,以方便研究。他们发现生长因子鸡尾酒可以让类器官的细胞无限分裂。
衍生自胚胎干细胞的类器官反过来又允许研究人员模拟器官在子宫内的发育,并研究影响器官发育的因素。Prins使用胚胎前列腺类器官来模拟内分泌干扰物质(如BPA)对前列腺发育的影响。Prins和实验室的其他成员都希望了解如何引导胚胎干细胞形成前列腺,以及暴露于各种物质的时间点。他们发现,如果发育期间被暴露于BPA,那么前列腺就会产生更多的干细胞样细胞。这些细胞是无法转化成真正的前列腺细胞的。
Prins指出,如果没有类器官,这项工作根本不可能完成。有了这些3D细胞培养物,你就可以专注研究对器官的直接影响。Prins还表示,她既无法在体外2D模型中随时观察细胞增殖差异,因为细胞组织排列散乱、不规则;也无法在体内2D模型中单独观察和区分前列腺发育情况。
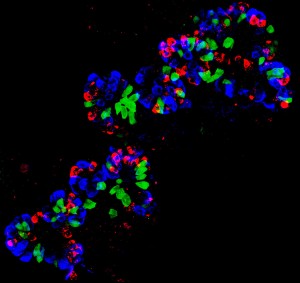 图为小鼠肠组织类器官,绿色标记的是CDLK1蛋白——一种簇绒细胞的特异性标志物;蓝色标记的是溶菌酶——潘氏细胞的特异性标志物;红色标记的是嗜铬粒蛋白A——肠内分泌细胞的特异性标志物。
图为小鼠肠组织类器官,绿色标记的是CDLK1蛋白——一种簇绒细胞的特异性标志物;蓝色标记的是溶菌酶——潘氏细胞的特异性标志物;红色标记的是嗜铬粒蛋白A——肠内分泌细胞的特异性标志物。
脑部类器官
研究人员不仅对身体各器官进行了类器官建模,也成功对脑部进行了类器官建模。
21世纪初,剑桥大学(University of Cambridge)神经科学家Madeline Lancaster并不打算创建大脑类器官,当时她还在维也纳分子生物学研究所(Insitute for Molecular Biotechnology)Jürgen Knoblich实验室做研究。Lancaster当时尝试从胚胎干细胞中创建2D模型的脑细胞。结果让她十分沮丧:这些细胞不贴壁,相反,它们形成球形,漂浮在培养液中。经过仔细检查,她意识到这些细胞自发组成微型大脑,形成不同的大脑区域。
Lancaster表示,大脑类器官的最大优点是来源于人体,并且显而易见我们不可能对人进行活体大脑研究。她的工作重点是使用胚胎干细胞衍生的类器官来模拟正常的大脑发育,并研究可能影响这一过程的疾病,例如大部分发生在妊娠前3个月的小头症(microcephaly)。她还使用患者来源的iPSC来研究发育相关疾病。
Lancaster及其团队使用的大脑类器官包括大脑的多个区域。但其他研究人员关注的,可能只是脑的某一部分。例如,约翰霍普金斯大学(Johns Hopkins University)的Guo-Li Ming构建了仅包含前脑部分的、源于胚胎干细胞的类器官。Ming指出,这是一种简化方法,它有助于对前脑发育的深入研究,并可以模拟妊娠中期的脑发育过程。
Ming的实验室是率先模拟Zika病毒如何引起婴儿小头症的实验室之一。她在前脑发育的不同阶段使用病毒感染前脑组织,并注意到即使培养基中的Zika病毒被清除,也还是能够在神经干细胞中传播。
Ming还指出,一旦病毒进入脑细胞,就会阻止之后的细胞增殖。而最引人注目的发现是,感染Zika病毒后,类器官会越长越小;如果你解剖它,就会发现,与健康的类器官相比,感染后的前脑类器官的干细胞层以及皮质层会明显减少。
 Madeline Lancaster使用类器官研究大脑发育。
Madeline Lancaster使用类器官研究大脑发育。
回归问题本质
大脑是最复杂的器官,它包含数千种类型的神经元,神经元之间有数万个连接。鉴于此,即便是3D大脑模型,它能提供的信息也是相当有限的。
大脑的复杂性让研究者很难控制类器官中各种类型的细胞的分布。Lancaster指出,大脑类器官里也有不同的大脑区域,如皮质、海马、脊髓和视网膜,但它们的位置是随机的。虽然她和她的团队可以观察到这些不同的脑区,并看到它们之间的一些联系,但类器官完全不具备真正大脑的功能。
另外,分化的大脑类器官很快会遇到供给方面的问题。当大脑在子宫内发育时,神经元在脑室周围形成。通常,血管细胞分布在这些脑室的内侧,为神经元提供氧气和营养物质。但由于类器官仅由神经元组成,所以处于中间位置的神经元会很快死亡。Lancaster表示,尽管类器官可以存活长达一年,但其中的神经元会更早死亡。从形态上讲,即使存活了一年的大脑类器官,看起来还是和9-10周龄的胚胎大脑差不多。
其中一种控制不同“批次”类器官之间的差异,并延长存活时间的方法是仅研究大脑的一个部分,就像Ming所做的一样。Ming实验室生产的前脑组织与细胞组织在形式上较为相似,因为组成前脑的神经元种类更少。而且前脑相对小,可以一直生长到怀孕第24周对应的发育生长点。
然而,这本身就是一个折衷选择。Ming指出,如果你只有大脑的一部分,你就无法研究这部分与其它部分间的沟通,也就是失去了一部分复杂性。不过,神经元之间的联系需要更长的发育时间,这不是她研究的重点。
目前,类器官面临的困境是,它们可以用来回答以前无法回答的特定问题,但通常只能解决有限的问题。Lancaster可以使用她的模型来研究非常早期的大脑发育,而Ming则专注于与前脑相关的问题。每种类型的类器官都有自己的优势。
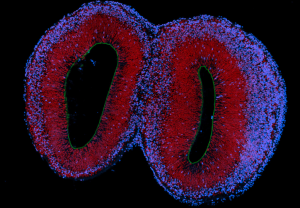 由iPSC产生,在生物反应器中培养的人前脑组织类器官。PKCλ(绿色)标记的是粘着连接,DAPI(红色)标记的是细胞核,CTIP2(蓝色)标记的是神经元。
由iPSC产生,在生物反应器中培养的人前脑组织类器官。PKCλ(绿色)标记的是粘着连接,DAPI(红色)标记的是细胞核,CTIP2(蓝色)标记的是神经元。
事实上,类器官的局限性不仅于此。类器官通常仅含有上皮细胞,但这些仅是器官的一个组成部分。可以肯定的是,Clevers的小组已经使用各种相关的上皮细胞,包括那些分泌粘液和激素的上皮细胞,来构建肠组织类器官。但真正的器官还应包括血管细胞、神经,以及作为支架、支持结构的成纤维细胞。
Bissell指出,如果环境合适,人身上的每个细胞都具有无限潜能。但是在缺乏完整细胞类型的情况下,类器官始终无法获得这种合适的环境。
事实上,类器官缺少的不仅仅是细胞类型。身体中的器官被肌肉包围,并且血液中的免疫细胞时不时造访。消化道中的器官也受到生活在其中的几十亿细菌的影响,目前这些细菌还不能被移植到类器官中。
但并非所有的研究人员都认为这是缺点;Prins认为,在没有其它类型的细胞存在的情况下,我们可以更直接地观察毒素对前列腺细胞发育的作用。如果这种毒素对前列腺的影响只是对免疫腺的影响,那么在前列腺类器官上我们应该不会看到这种毒性作用。
改善现状
不过,化学家和生物医学工程师正在努力让类器官更贴近真实器官。他们采取的方法分成两种:改善细胞周围环境,或设计包含更多细胞类型的类器官。
类器官的构建模式很大程度上依赖于其悬浮的培养基。最常用的培养基是基质胶(matrigel),这是由一种小鼠细胞的胞外蛋白质组成的胶,它可以为类器官提供营养。每种类型的类器官都有适合自己的基质胶。
弄清楚这些细节需要反复测试、纠错。瑞士洛桑科技大学(École polytechnique fédérale de Lausanne)生物医学工程师Matthias Lütolf表示,尽管基质胶取得了巨大成功,但仍有提升空间。由于目前类器官的质量不好控制,所以类器官还不能用于临床或药物检测。Lütolf还指出,获得的每批类器官都会有所差异。
改善基质胶的难点在于,类器官本身变化非常迅速——在某一段时间适合它的培养基,隔一段时间,可能就不适合了。但是,Lütolf认为,这可以通过重新设计模型系统来改善。他们的想法是,不需要一开始就形成一个非常复杂的系统,然后不断移除某些部分,相反,我们可以以其它方式来控制整个系统。Lütolf和他的小组目前正在尝试通过基质胶提供细胞外基质信号,以便使不同的细胞可以在不同时间或不同程度下获得不同的化学物质,甚至可以获得来自不同光照的信号。从理论上讲,这可以让科学家“哄骗”干细胞在同一培养基中分化成更多的细胞类型。
即使类器官可以包含更多种类型的细胞,但如何增加类器官的体积也是个问题。Lütolf表示,生物反应器可以使微型脑体积更大,但是由于内部细胞缺乏营养,所以它们迟早会死亡。
因此,类器官必须包含血管和神经等细胞。但增加额外细胞类型,特别是与类器官完全不同的细胞类型,可能会带来新的问题。Lancaster表示,对脑组织起作用的因素可能对血管细胞有相反作用。
然而,一些模型已经成功加入多种细胞类型。2016年,辛辛那提儿童医院(Cincinnati Children's Hospital)内分泌学家Jim Wells和他的研究小组分开培养神经组织和肠道组织,然后将它们放在一起,使它们能够自我组装。斯坦福大学(Stanford University),的SergiuPaşca和他的团队也通过采用类似的整合方法,将多种类型的皮质球体融合在一起,产生了脑组织。
大脑皮层由兴奋性和抑制性神经元组成。Paşca指出,在子宫内,在早期发育阶段时,这些神经元是在不同的区域产生的,然后迁移到一起,形成皮层回路。直到最近,Paşca和他的团队才分开培养了多种神经元,然后把它们组装到一起。他们找到了一种把它们培养在一起的方法,并且它们融合在一起了。Paşca认为这些球体将会被制成可用于研究自闭症或癫痫的模型。目前这两种疾病都被认为是由兴奋性神经元和抑制性神经元神经元之间的错配而引起的。维也纳分子生物学研究所(Insitute for Molecular Biotechnology)的Knoblich团队最近报道了一种类器官融合方法,并用它来模拟大脑区域之间的神经元运动。
当然,随着类器官技术的不断改进,关于其在研究使用中的伦理问题也开始备受争议。这些类器官何时会变成真正的器官?如果类器官来自患者,这些患者对自己的离体肝脏或肾脏有所有权吗?患者的类器官大脑能够自己思考吗?
目前的类器官还过于简单,以致不会面临以上问题,不过它们非常适合作为研究模型。尽管类器官永远不能完全替代体内或体外2D模型,但这些培养物已经在生物学研究中占有一席之地了。正如Prins所说,所有生物研究最重要的一点是,你需要联合使用多个模型。
原文检索:
Katherine Ellen Foley. (2017) Organoids: a better in vitro model. Nature Methods, 14 (1038): 559-562. 张洁/编译