RNA编辑大显神通
改变合成蛋白质的分子信使——mRNA——可能会为癌症、疼痛或高胆固醇提供灵活的治疗方法,此外还可能治疗遗传疾病。
Thorsten Stafforst在最糟糕的时候做出了自己的重大突破。2012年,他在德国图宾根大学(University of Tubingen)的团队发现,通过将酶与经过工程处理的RNA链连接起来,可改变细胞内mRNA分子的序列。本质上,他们可以在细胞合成蛋白质的过程中重写基因组的指令。
从理论上讲,编辑mRNA分子可以用于治疗多种疾病,包括那些有遗传基础的疾病,以及那些能从蛋白质的数量或类型的变化中受益的疾病。但Stafforst在发表这一发现时遇到了很多麻烦,因为这个发现没有那么有趣了。因为仅在几个月前,有文章指出,DNA编辑工具CRISPR-Cas9可以永久性地改变基因组,这一发现令他的发现黯然失色。
自那时起,CRISPR成为了实验室的常用手段,并催生了许多旨在利用该技术开发药物和治疗的公司。Stafforst指出,当CRISPR吸引了所有人的注意力时,人们对他的论文漠不关心。他们会问,当有DNA编辑工具时,我们为什么还需要mRNA编辑工具?
但事实证明,CRISPR编辑技术——至少作为一种治疗人类的技术——比最初想象的要困难得多。研究人员记录了Cas9,一种用于CRISPR基因编辑的酶,可以触发免疫反应,或者导致永久的基因组意外改变。相比之下,RNA编辑可以让临床医生进行临时修复,消除蛋白质的突变,停止它们的产生,或者改变它们在特定器官和组织中的工作方式。由于细胞会迅速降解未使用的RNA,因此治疗中出现的任何错误都会被覆盖掉,而不是永远留在一个人的体内。
现在,人们终于开始热衷于RNA编辑了。根据论文摘要和引文数据库Scopus的数据,2019年,研究人员发表了400多篇关于RNA编辑的论文。一些初创公司开始使用RNA编辑系统来开发各种可能的治疗方法,从肌肉萎缩症等遗传疾病到急性疼痛等暂时性疾病。尽管基于RNA的药物由于在传递和耐受性方面的挑战而难以进入市场,但过去几年的一些监管批准可能有助于为RNA编辑疗法铺平道路。
目前还存在几个挑战:目前的技术只能以几种有限的方式改变RNA序列,而让该系统在人体中正常工作将是一个挑战。尽管如此,研究人员仍然希望新的技术,如蛋白质工程,以及将RNA传递到细胞的改进方法能够帮助克服这些限制。Stafforst真的认为RNA编辑打开了一个新世界。
RNA的作用
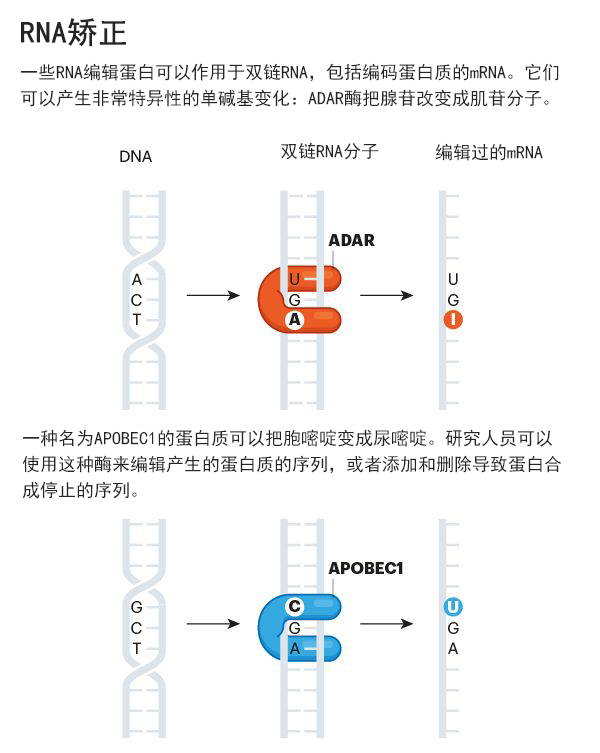
根据分子遗传学的一个基本原则——中心法则,细胞机器忠实地将遗传信息从双链DNA模板转录成单链RNA信使,然后翻译成蛋白质。但是在20世纪80年代,一些实验室注意到一些mRNA转录包含了改变的或额外的碱基,这些碱基并没有在DNA中编码。这些发现一直备受争议,直到科学家发现一种名为腺苷脱氨酶的酶家族作用于RNA 。这些蛋白质与RNA结合,通过将一种常见的腺苷碱基转变成肌苷分子来改变其序列。虽然肌苷不是一个标准的RNA碱基,但它被细胞的蛋白质翻译机制解读为我们熟悉的鸟苷。与此同时,一些其它的RNA编辑酶也陆续被发现。
过去三十年来,科学家一直在努力理解RNA编辑到底能起到什么作用。RNA编辑器只对双链RNA起作用,有时在细胞中以调控元件或病毒的形式出现。一些人推测,ADAR蛋白的进化是为了防御病毒,但许多携带双链RNA的病毒似乎并不受该酶的影响。这种编辑可能具有调节功能,但大多数成年组织不能产生编辑所需的高水平ADAR。
盐湖城犹他大学(University of Utah)的生物化学家Brenda Bass是最早在青蛙胚胎中发现ADAR的人之一。她指出,目前还没有人发现非蛋白质编码RNA(大部分被编辑的RNA是非编码RNA)的变化有什么特别的作用。这种编辑的可能作用是保护双链RNA免受免疫攻击。Bass怀疑ADAR编辑了双链转录本,加入肌苷来告诉身体不要干扰这些双链RNA。这种酶似乎在胚胎发育中也有作用:缺少ADAR基因的小鼠在出生前死亡,或出生后不久死亡。编辑器似乎也对某些成年生物的特定组织有作用,例如头足类动物的神经系统。
正是这些发现吸引了海洋生物学家Joshua Rosenthal在21世纪初投身RNA编辑领域。他发现,高智商的头足类动物,如乌贼、乌贼和章鱼,似乎广泛地利用RNA编辑来调整参与神经细胞发育和信号传递的基因。目前还没有其它动物以这种方式使用RNA编辑。受到这些观察结果的启发,Rosenthal想知道是否有可能在治疗环境中使用该系统来纠正功能失调基因产生的信息。2013年,他在波多黎各大学(University of Puerto Rico)圣胡安分校的团队重新设计了ADAR酶,并将其连接到RNA上,引导RNA与mRNA上的特定位点结合,形成双链。有了这些,他们就能够编辑青蛙胚胎中的转录本,甚至编辑培养的人类细胞中的转录本。
与Stafforst相似,现在马萨诸塞州伍兹霍尔海洋生物实验室(Marine Biological Laboratory)工作的Rosenthal也发现,他的论文几乎被忽略了。他了解到,类似的命运也发生在一家名为Ribozyme的公司的研究人员身上。1995年,Ribozyme提出将互补序列插入青蛙胚胎,产生双链分子,然后让ADAR编辑该双链RNA分子,并纠正突变,从而对突变的RNA序列进行“治疗性编辑”。
但在过去的几年里,多种因素汇集在一起,使Rosenthal和Stafforst的发现从众多科学发现中重见天日。加州大学戴维斯分校(University of California, Davis)的化学家Peter Beal表示,2016年公布的ADAR与双链RNA结合的分子结构使这个系统更容易被理解,并使科学家能够更好地设计这种酶,以增强其传递或提高其效率。在2018年,美国FDA批准了第一个使用RNAi的治疗方法:一种将一小块RNA插入细胞中,使其与天然mRNA结合并加速其降解的技术。荷兰莱顿ProQR Therapeutics公司的首席创新官Gerard Platenburg指出,这项批准为涉及mRNA相互作用的其它疗法打开了大门。该公司正在研究各种基于RNA的疗法。Platenburg表示,从过去的经验中学习,随着审批数量的增加,这个领域已经成熟了很多。
许多人将RNA编辑视为使用CRISPR等技术来替代DNA编辑的一个重要选择。CRISPR技术正在改进,但DNA编辑可能会在基因组的其它部分造成不必要的突变——“脱靶效应”——这可能会产生新的问题。
此外,Rosenthal预计,RNA编辑对没有遗传来源的疾病可能也有用。他目前正在使用ADAR编辑钠通道Nav1.7基因的mRNA,该基因控制疼痛信号如何传递到大脑。通过DNA编辑永久改变Nav1.7基因可以消除个体感知疼痛的能力,破坏该蛋白质在神经系统中的其它必要功能,但通过RNA编辑下调该蛋白的表达,可以在有限的时间帮助特定组织减轻疼痛,而不产生与传统止痛药类似的药物依赖或成瘾的风险。
类似地,RNA编辑可以让研究人员模拟那些对健康有益的基因变异。例如,调节血液中胆固醇水平的PCSK9基因发生某些突变的个体,胆固醇水平往往较低,而修改PCSK9 mRNA可以带来类似的优势,而不会永久性地破坏蛋白质的其它功能。海德堡德国癌症研究中心(German Cancer Research Center)的免疫学家Nina Papavasiliou指出,RNA编辑可以用来对抗肿瘤。一些癌症会劫持重要的细胞信号通路,例如那些与细胞死亡或增殖有关的细胞信号通路。如果RNA编辑器能够暂时关闭关键的信号分子,我们就能看到肿瘤死”。然后,患者可以停止治疗,让通路恢复正常功能。
作为一种治疗方法,RNA编辑可能比基于CRISPR的方法更不容易引起潜在的危险的免疫反应。与来自细菌的DNA编辑酶Cas9不同,ADAR来自人体,不会引发免疫系统攻击。此外,正如加州大学圣地亚哥分校的生物工程师Prashant Mali所说,不需要大型分子机器来定位RNA。
在去年发表的一篇论文中,Mali等人将向导RNA注射到天生带有导致肌肉萎缩的基因突变的小鼠体内。这种向导RNA被设计用来触发一种缺失的蛋白质——肌营养不良蛋白的产生。尽管该系统只编辑了少量编码肌营养不良蛋白的RNA,但它将该蛋白恢复到了动物肌肉组织中正常水平的5%左右,这个比例显示出了巨大的治疗潜力。
在其它由蛋白质缺失或功能失调引起的疾病中,如某些类型的血友病,Stafforst认为,从无到有是有很大区别的,而且可能没有必要编辑体内每个细胞的RNA。RNA编辑可能比注入新基因的基因疗法效果更好。Mali等人表示,引导原生的ADAR对细胞自身的信使RNA进行操作,相比引入外部的工程基因更能提供更自然的反应。
然而,即使是在实验室应用方面,RNA编辑技术也远非完美。Bass提醒,现在还为时过早,还有很多问题需要解决。由于ADAR的效率远远低于CRISPR,它们在制造转基因动植物方面的作用可能会更小。加州斯坦福大学(Stanford University)的遗传学家Jin Billy Li则指出,作为一种研究工具,ADAR的能力非常有限。
另一个主要的缺点是ADAR只能对RNA进行几种改变。CRISPR系统就像剪刀一样,在指定的位置切割DNA,然后移除或插入一个新的序列;而ADAR更像是一种从化学上改变碱基的重写功能,不会破坏RNA分子的“主干”。
虽然这个过程不太可能引起意外的突变,但它限制了酶做出特定的改变——在ADAR的情况下,只能由腺苷变成肌苷,胞嘧啶变成尿苷(这是通过一组叫做APOBEC的酶实现的,图“RNA矫正”)。但自然界还提供了一些其它的可能性。例如,葡萄科植物可以将胞苷转化为尿苷,一些肿瘤可以将鸟苷转化为腺苷。Rosenthal表示,生物多样性给了我们无数的答案。他认为,例如像乌贼这样的生物最终会教会我们很多东西。但是这个领域还没有得到充分的研究——研究人员不了解这种编辑的过程。例如,一种植物酶是否能在人类细胞中起作用,还有待观察。
科学家已经在寻找制造新酶的方法,以扩大RNA编辑能力。剑桥麻省理工学院(Massachusetts Institute of Technology)的生物工程师Omar Abudayyeh指出,这是一个你不知道会发现什么的过程。Abudayyeh等人与麻省理工学院的CRISPR先驱张锋(Zhang Feng)合作,将一种ADAR酶与Cas13连接起来。Cas13是一种类似于CRISPR相关蛋白Cas9的细菌酶,可以切割RNA而不是DNA。研究人员改变了ADAR的序列,直到它可以将胞苷转化为尿苷。然后他们在人类细胞中使用这个新系统来改变几个基因(包括APOE)编码的信使RNA中的碱基。这种基因的一种自然发生的遗传变异与阿尔茨海默病有关,对其进行编辑可以将这种变异转化为无害的形式。
Abudayyeh和他在麻省理工学院的合作者、生物工程师Jonathan Gootenberg承认,改变ADAR蛋白可能会导致免疫系统停止识别它是一种天然的人类蛋白,进而攻击含有这种蛋白的细胞。但是他们提醒,因为这些编辑是很小的,所以与已知的免疫系统攻击Cas13或将编辑工具送入细胞的病毒的风险相比,这种风险就显得微不足道了。
研究人员在一种被称为假尿苷化(pseudouridylation)的自然过程中看到了希望。在这个过程中,一组蛋白质和RNA酶以化学方式改变了mRNA中尿苷的结构。与ADAR修饰不同,假尿苷化不会改变mRNA或蛋白的序列。相反,由于不完全清楚的原因,这一过程稳定了RNA分子,并导致翻译机制忽略指示其停止制造蛋白质的信号。
如果能将这些mRNA的停止信号转变成运行信号,那么能做的事儿就很多了。纽约罗彻斯特大学(University of Rochester)的生物化学家Yi-Tao Yu指出,数百种遗传疾病都是由DNA突变引起的,这些突变在mRNA中产生了错误的停止信号,导致蛋白质缩短,无法在体内正常发挥功能。由mRNA分子产生错误停止信号导致的疾病很多,包括囊胞性纤维症、眼部疾病Hurler综合症和许多癌症。
尽管处于早期阶段,但研究人员和生物技术投资者对RNA编辑的广泛潜力感到兴奋。Papavasiliou表示,他已经习惯了这种突然的大火,多年来,这个领域一直都是一潭死水,突然间,每两周就会冒出一家公司。
许多初创公司和老牌DNA编辑公司都宣布了进军RNA领域的意向。其中包括马萨诸塞州波士顿的Beam Therapeutics公司,该公司由Zhang和Liu联合创办,他们一直在开发CRISPR DNA编辑技术,以作为治疗多种血液疾病的手段。总部位于圣地亚哥的Locana公司也在研发基于CRISPR的RNA编辑技术,希望能治疗包括运动神经元疾病和亨廷顿舞蹈症在内的疾病。
工业界面临的挑战是找出最佳的方法,在不触发免疫反应或导致细胞降解的情况下,让这些引导RNA进入细胞。Beal指出,这可能包括对RNA进行战略性的化学修饰以稳定它们,或者将它们嵌入到可以潜入细胞的纳米颗粒或病毒中。
尽管ADAR已经存在于人体细胞中,但人体在大多数组织中只产生少量的ADAR,这意味着任何治疗都可能需要添加ADAR或其它酶来增强细胞的编辑能力。载带编码RNA编辑所需的所有分子的基因的病毒包装系统可能效率不高。许多人也希望尽量不采用这种方式。
Platenburg希望添加RNA,并依靠自然产生的ADAR来帮助纠正导致视网膜疾病的mRNA的碱基。他指出,我们应该利用大自然赋予的系统,并驾驭它。
包括Stafforst在内的研究人员正在对向导RNA进行工程化化学修饰,从而将细胞中的ADAR吸引到编辑位点。但一些研究人员担心,把天然的ADAR召集到编辑特定的mRNA中,可能会影响ADAR的正常功能,导致其它健康问题。改变身体某个部位的基因表达可能会以不可预见的方式影响其它部位,这仍是一个发展中的工具。
Nessan Bermingham表示,ADAR已进化到允许身体以一种非常有针对性的方式修改碱基。Bermingham对RNA编辑的前景持乐观态度,但他认为还有很多工作需要做。他提醒,随着这些技术的成熟,我们还有很多工作要做。我们不会放弃任何有潜力的工具,但我们必须认识到某些限制。
原文检索:
Sara Reardon. (2020) Step aside CRISPR, RNA editing is taking off. Nature, 578: 24-27.
张洁/编译