球形的魔力
排列成球形(spherical shape)的DNA或RNA分子,可以攻击脑肿瘤,以及其它用传统药物治疗无效的疾病。
脑肿瘤是非常恐怖的疾病。大脑一向被看作是人类性格、思想和人性的起源,而脑肿瘤就是影响大脑的恶性疾病。而且由于脑肿瘤生长在大脑里,所以很难被干预和治疗。虽然我们的大脑进化出多种防御机制,来抵御外来物质的入侵,但这同样也将抗癌药给挡在了外面。手术或放疗的方式又充满了危险。因此,对于胶质母细胞瘤(glioblastoma)这种最常见的脑肿瘤来说,年龄介于55至64岁的患者的5年生存率仅有5%。在美国,每年有大约1.5万人死于该疾病,John McCain、Edward Kennedy和Beau Biden等名人也全都死于该疾病。
现在,我们开发出了一种纳米级的新药,它可以进入人体的大脑,消灭脑肿瘤细胞。这些药物就是球形的RNA或DNA核酸分子。这些核酸就好像海胆长出的刺一样,可以“命令”细胞执行相应的指令,我们将这些“海胆”称作球形核酸(spherical nucleic acid, SNA)。在一个有8名患者参加的早期临床试验里,这些SNA都进入了胶质母细胞瘤细胞里,并且与促进肿瘤细胞生长的那些分子紧密地结合在一起。
这种球形分子在理论上可以治疗多种疾病。比如另外一种可怕的、主要侵犯婴幼儿的疾病——脊髓性肌肉萎缩症(spinal muscular atrophy, SMA)。这种疾病会使患儿的肌肉萎缩,最终表现为吞咽和呼吸困难。大多数患儿都无法进入幼儿园,而且目前的医疗手段对这种疾病也是束手无策。2016年,FDA批准了一款名为Spinraza的药物上市。直接将该药物注入患者的脊髓内进行治疗,每年需要注射多次。每一针的价格是12.5万美元,这是目前世界上最贵的药物。我们最近用啮齿类动物模型对SNA药物进行了测试,选择的对照药物就是Spinraza。结果发现,SNA药物可以将试验动物的存活率提高四倍,即使用SNA药物的试验动物的平均存活期为115天,而使用Spinraza的试验动物的平均存活期仅为28天,而且我们的毒副作用也要比Spinraza低得多。
SNA药物能够避开传统新药研发工作中碰到的很多问题。比如,传统药物的研发工作都是非特异性的,这些药物会影响多种不同的细胞和器官,而不是疾病本身,因此,这些药物或多或少都存在一些毒副作用。而核酸类药物则不同,我们可以根据致病基因,或者相关的分子,设计出高特异性的核酸药物,然后让这些核酸进入细胞内,发挥治疗功效。生物学家早就已经尝试将核酸分子送入细胞进行治疗,不过之前使用的都是线性核酸分子,而且靶向性还不够高。这是因为人体对外源性的遗传物质具有很强的防御能力(在大多数情况下,指的主要是免疫系统),几乎能够立刻摧毁这些核酸类药物,或者将其运送至肝肾等器官,加以降解和清除。
不过,这些只有纳米大小的SNA分子就不同了,它们几乎可以在被免疫系统阻截之前,就进入人体里的任何部位,进入每一个细胞。球状的外形也是一大优势,它们可以将大量的核酸分子装在一个非常小的空间里,同时又能够与细胞表面的受体发生非常强烈的相互作用。而核酸分子的特性,又决定了这些药物只会与序列互补的特定DNA或RNA发生相互作用,继而影响细胞的行为。我们只会针对细胞内最关键的致病序列设计相应的SNA药物。不过,这些SNA分子可不是魔术子弹,在真正投入临床造福患者之前,还需要进行大量的临床测试。即便如此,这种技术的潜力还是显而易见的,这些核酸序列都可以根据需要来随意设计,鉴于此,理论上这种药物可以治疗所有致病基因明确的疾病,包括很多目前被看作是绝症的疾病。
设计药物
传统上,科学家发现新药的方法就是对成千上万的各种分子(包括人工合成的和天然的)进行筛选。这就是一个漫长的试错过程,大海捞针一般地找出可能有治疗作用的分子。虽然我们也通过这种方法找到了很多很好的药物,比如抗生素等,但是即便是非常好的药物,也还是存在毒副作用的问题。而且,目前有很多疾病是没有药物可以治疗的。即便是目前最火的生物类(蛋白质)药物,也是按照这种模式开发出来的。
这种大海捞针式的药物开发模式显然不够理想,最理想的药物设计模式,应该是让科研人员按照细胞的语言,快速设计出最合理的药物。细胞之间通过DNA和RNA这些核酸分子为语言,借助数百万的蛋白质进行交流。细胞为了保证能够正确地生产出这些蛋白质,设计出了一整套非常严谨的流程,即我们熟知的DNA转录、翻译流程。
如果DNA链上出现了插入、缺失和倒位等突变,就会生成错位的蛋白质,最终导致疾病发生。如果某种蛋白质形成过多(比如在病毒感染时,细胞里大量表达病毒蛋白时),也有可能导致疾病。
不过,我们也可以自己合成DNA或RNA寡核苷酸分子。由于核酸分子具有非常严格的互补配对特性,因此,我们可以设计出与致病核酸分子严格互补结合的人工核酸药物。一旦互补结合之后,人工核酸药物就可以“锁住”致病核酸分子,使其不再能够翻译出致病的蛋白。
尽管借助自动化设备,我们可以快速生产出各种序列的人工合成的寡核苷酸,但是到目前为止,获批上市的寡核苷酸药物还非常少,不够一打的数量。这主要是因为,这些外源性的寡核苷酸被注入人体后,会被人体当作是有害的物质,进而被人体的免疫系统破坏,或者被肝肾等器官清除,无法到达需要发挥作用的靶器官,从而真正发挥治疗作用。即便这些寡核苷酸药物能到达靶细胞,但是细胞膜还是会阻止它们进入细胞。因此,开发寡核苷酸药物的制药公司通常都会选择肝脏疾病作为开发目标。肝脏的确是非常重要的器官,但是把新药开发的焦点仅限于肝脏,还是太局限了。如果直接将寡核苷酸药物注射入靶器官内(例如直接注入脊髓的Spinraza),这又不太适合临床使用,而且仍然不能保证让药物进入靶细胞。
令人震惊的结果
由于美国西北大学(Northwestern University)在纳米科技方面有自己的独到之处,因此,我们和其他科研人员一起开发的SNA药物,就很好地解决了上面提到的种种问题。早在2006年,我们课题组就开始关注这个领域。我们利用SNA具有高度特异性的结合特点,开发出了超敏感的诊断手段,用来对血液里的肿瘤DNA片段进行筛查。我们还用化学修饰的手段,在纳米金颗粒上添加了很多DNA片段,得到了海胆样的产物。这些DNA片段都是很好的探针,能与肿瘤DNA片段互补结合。我们还以这些纳米金球形颗粒为原子,开发出了很多新型的材料。但是在新药开发这个领域,还是没能取得太大的突破。毕竟,RNA和DNA这些核酸还是很难突破细胞膜屏障的。
但我们还是对这个领域很感兴趣,想了解核酸如何与人体各器官发生相互作用。之前,已经有很多科研人员用单链寡核苷酸进行过尝试,不过很少有人取得成功。我们根据对SNA诊断技术的了解发现,靶标DNA和RNA是能够与我们的“海胆”颗粒结合的,而且结合力要比游离的寡核苷酸高的多。主要原因就是,我们的核苷酸都是密集压缩在球形的“海胆”核心上的。这就让核苷酸竖得更直,有利于每一个碱基充分地暴露出来,与靶标核酸分子互补结合。这一发现让我们有理由相信,这些SNA是有希望成为药物的。
为了验证这个想法,我们开展了一次试验,不过最开始,我们也没抱太大的希望。我们在试管里,将荧光标记的游离寡核苷酸与小鼠细胞混合在一起,作为对照组。在另一管细胞里,我们将荧光标记的SNA与同样的小鼠细胞混合在一起,作为实验组。然后在显微镜下观察,结果发现,对照组细胞内几乎不含荧光标记,因为这些游离寡核苷酸无法透过细胞膜进入细胞。但是实验组细胞里就出现了红色的荧光,这说明球形分子的确起作用了。
可是原因究竟是什么呢?哪些分子能够通过细胞膜是有严格限制的,寡核苷酸并不没有通行证。因为寡核苷酸和细胞膜一样,都携带负电荷,也遵循同性相斥的规律。因此,我们使用了50多种不同的人体和动物细胞做实验,只成功过一次。
不过我们已经发现了问题所在,那就是细胞表面的scavenger受体。这些受体会允许纳米大小的生物分子通过细胞膜。而SNA上结合的寡核苷酸末端的结构,就和scavenger受体天然底物的结构非常类似。这些SNA上紧密排列的寡核苷酸就好像尼龙搭扣,搭扣越多,粘合力就越强。而游离的寡核苷酸就好比只有一个搭扣,因此结合力就差了很多,很难透过细胞膜进入细胞了。
在电镜下,我们发现,SNA一旦与scavenger受体结合,附近的细胞膜就会内陷,将SNA吞入细胞。
球形在医疗领域的应用
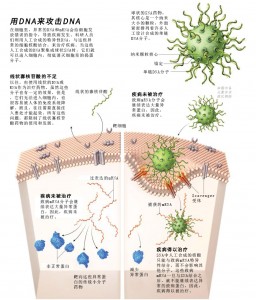
但是进入细胞还只是万里长征第一步。SNA要起到药效,首先还得找到致病的靶标mRNA,并与之结合,使其失活。
不过,我们最开始在细胞里选择的靶标mRNA并不是致病mRNA,而是绿色荧光蛋白编码mRNA。我们用小鼠细胞进行了试验,使其与特异性识别绿色荧光蛋白编码mRNA的SNA混合,结果在显微镜下果然再也看不到那些绿色的细胞了。该试验结果于2006年发表在了《科学》(Science)杂志上。
接下来,我们又开展了另外一项攻关,要解决困扰线性寡核苷酸的一大问题,即跨越生理性的保护屏障,避免被人体降解和破坏。我们发现,我们的球形分子由于紧密组装的缘故,所以带有很强的电荷,这同时也有利于它们躲避机体免疫系统的攻击。这种强电荷能够抑制人体内核酸酶与SNA分子靠近、结合,所以能够避免被这些核酸酶降解。
临床试验
继我们取得成功之后,其他一些科研人员也都独立地重复出了我们的试验结果,而且还有了更进一步的发展。比如皮肤科医生Amy Paller、SMA领域里的专家Arthur Burghes、免疫治疗专家Bin Zhang、肿瘤生物学家Alex Stegh、移植专家Jason Wertheim和肿瘤学家Priya Kumthekar等人。但是,从实验室走向临床,还是一条漫长且艰巨的道路。因此,我们课题组在差不多十年前,创办了Exicure公司,专门从事SNA药物的研发工作。
我们最开始研究的问题就是,这些球形分子能否通过润肤霜或眼药水等非侵入式的给药方式,抵达患病组织和器官,被细胞吸收,发挥治疗作用。我们最开始选择的治疗方向就是银屑病(psoriasis)和难愈合的创口。目前,在这些领域,已经有好几个非常有希望的SNA药物,进入了早期临床试验阶段。当然,皮肤是药物比较容易到达的部位,但大脑可就不同了。在免疫系统和血脑屏障的重重保卫之下,外源性物质很难进入脑内,这也是脑部疾病很难治疗的原因之一。不过,我们认为,SNA既然能够轻易地穿过细胞膜,那么也应该能够透过血脑屏障。一旦进入大脑组织,这些球形颗粒就可以自动进入肿瘤细胞,发挥出药效。
于是,我们针对胶质母细胞瘤细胞里的Bcl2L12蛋白编码序列设计了相应的SNA药物。这是因为,Bcl2L12蛋白是肿瘤细胞的生化防御武器,有利于肿瘤细胞行使恶性功能。如果SNA药物能够抑制肿瘤细胞表达Bcl2L12蛋白,那么,肿瘤细胞也许就会变得“脆弱”,再也无法抵抗传统抗癌药物的攻击了。我们进行了动物试验,相关的结果于2013年发表在了《科学转化医学》(Science Translational Medicine)杂志上。我们发现,给小鼠血液里注入SNA,这些药物真的可以越过血脑屏障,进入小鼠脑内,并且能够抑制胶质母细胞瘤细胞表达Bcl2L12蛋白。去年的临床试验结果也发现,这些SNA药物能够进入胶质母细胞瘤患者的肿瘤细胞内。不过,患者并未被治愈,我们还需要确认,这些肿瘤细胞经SNA攻击之后,是否变得更加脆弱了。不过,该临床试验至少证明了,SNA可以越过血脑屏障,而且是安全无毒的,这就给我们提供了很大的信心,希望能够尽早开展后续的临床试验,而且也有信心用这种药物治疗更多的疾病。与此同时,针对包括脊髓性肌肉萎缩症等其它一些疾病在内的动物试验也取得了不错的结果。
SNA另外一大用途就是与免疫治疗联合,用于抗癌治疗工作。肿瘤细胞的细胞膜蛋白往往与其它细胞有所不同,因此,这些特异性的肿瘤细胞膜蛋白就好比一面面红旗,如果人体的免疫系统能够像发现流感病毒那样,识别并发现这些红旗,那么应该就可以特异性地摧毁肿瘤细胞了。
这就是SNA疫苗的原理。我们将SNA里核心的纳米金颗粒换成了同样是纳米大小的、中空的脂质体(liposome),然后在其中装入肿瘤细胞特异性的膜蛋白,这就构成了SNA疫苗。我们将这些疫苗注入患有相应肿瘤的动物模型体内,开展了动物试验。结果发现,这些SNA疫苗真的能够刺激机体免疫系统,产生相应的免疫反应,识别并消灭那些插有红旗的细胞。而且这些免疫反应持续的时间还很长,哪怕在SNA消失之后,免疫反应依旧存在。最新的研究成果已经发表在了今年的《美国国家科学院院报》(Proceedings of the National Academy of Sciences USA)上。1期临床试验也证实,这些SNA疫苗是安全有效的。我们同时也针对一种致命的皮肤癌,设计了SNA药物,并已经开展了临床试验。
不过,目前还没有一款SNA药物获得上市批准。还有一些问题需要先解决。比如,由于还没有针对很多细胞进行试验,因此,我们还不能断定,这些SNA药物不会出现脱靶问题。同时,还需要开展更大规模的临床试验,并且进一步提高靶向性,增加SNA药物进入靶细胞的数量。
SNA能够进入不同组织的特性,将彻底改变临床治疗的现状。SNA药物之所以能够出现,也得益于三大科技发展,即大批量生产寡核苷酸的能力、对疾病遗传背景的认识和了解,以及将寡核苷酸输送到组织和细胞里的能力。其中前两项进展更为重要,但也离不开第三项技术的辅助,就好像计算机必需需要硬件和软件,缺一不可。SNA就好比是关键的通用型硬件,略加改动,就可以适用于不同疾病的治疗。这也将彻底改变传统药物开发的现状。将来,在开发一种新药时,只需要设计一种新的寡核苷酸就可以了。这一切,即将到来。
原文检索:
Chad A. Mirkin, Christine Laramy and Kacper Skakuj. (2019) The Power of Spheres. Nature, 576: S4-S7.
Eason/编译

的DNA或RNA分子,可以攻击脑肿瘤,以及其它用传统药物治疗无效的疾病-300x243.jpg)