细胞来源流感疫苗提高疫苗有效性
2017-2018年,美国和澳大利亚以A(H3N2)亚型病毒为主的季节性流感疫情严重。虽然流行的A(H3N2)病毒与WHO建议的疫苗生产病毒在抗原上没有差异,但总体中期疫苗效力估计低于A(H3N2)病毒疫苗的历史平均水平(33%)。大多数(美国)或所有(澳大利亚)疫苗剂量都包含血球凝集素蛋白的多种氨基酸变化,这是由于病毒对大多数疫苗生产中使用的胚胎化母鸡的鸡蛋进行了必要的适应。以前的报告表明,由鸡蛋驱动的适应可能对疫苗性能产生负面影响。在美国生物医学高级研究与发展局(Biomedical Advanced Research and Development Authority, BARDA)的支持下,在美国获得许可的两种疫苗是在细胞培养中生产的:用昆虫细胞制造的重组流感疫苗(RIV, FlublokTM)和用哺乳动物细胞生产的灭活疫苗(ccIIV, FlucelvaxTM)。用于2017-2018流感季的四价ccIIV (ccIIV4)疫苗就是使用一种完全在细胞培养中繁殖的A(H3N2)种子病毒生产的,因此缺乏鸡蛋适应性变化。2017-2018年流感疫苗期间,分发的ccIIV剂量比较充足(但RIV分发剂量不足),足以支持研究者对其进行研究,并对比它与传统疫苗的有效性,但研究细节还未公开。一系列针对细胞疫苗和鸡蛋类疫苗的有效性评估的逐步展开,可能为今后疫苗产品的改进提供重要线索。
2017-2018流感疫情引起公众对公共健康的关注
从多个角度来讲,美国2017-2018年流感季都是自2009年甲型H1N1流感大流行以来最严重的一场流感疫情。流感病毒在11月初开始广泛传播,然后从12月到2月初大幅激增。在这次疫情中,A(H3N2)亚型病毒完胜B型流感病毒和A(H1N1)病毒,是主要的致病病毒,直到流感季末B型流感病毒活动达到高峰。流感样疾病(通过门诊和急诊就诊情况反映)的水平在最近流感季节最高。与前几年相比,美国2017-2018流感季的特点是多个州同时发生的、广泛且高强度的病毒循环。流感确认病例和住院率均超过2014-2015流感季。在该流感季,A(H3N2)病毒活动占主导,流感疫情被归类为高严重性。在欧洲,A(H3N2)病毒也与A(H1N1)和B型流感病毒一起在许多国家共同传播,而在过去20年南半球的最大流感疫情中,A(H3N2)病毒的作用相对小,B/Yamagata病毒占主导地位。
与由其它亚型引起的疫情相比,以A(H3N2)为主的流感疫情通常导致更高的感染率、住院率和死亡率,特别是在老年人中。美国疾病控制和预防中心(Centers for Disease Control and Prevention, CDC)根据对流感疾病负担的估计预测,在2012-2013年和2014-2015年等甲型流感(H3N2)流行季节,流感可能导致3560万人患病、1660万人就医、71万人住院、5.6万人死亡。同样,当甲型流感(H3N2)病毒占主导地位时,欧洲冬季流感的死亡率明显提高。
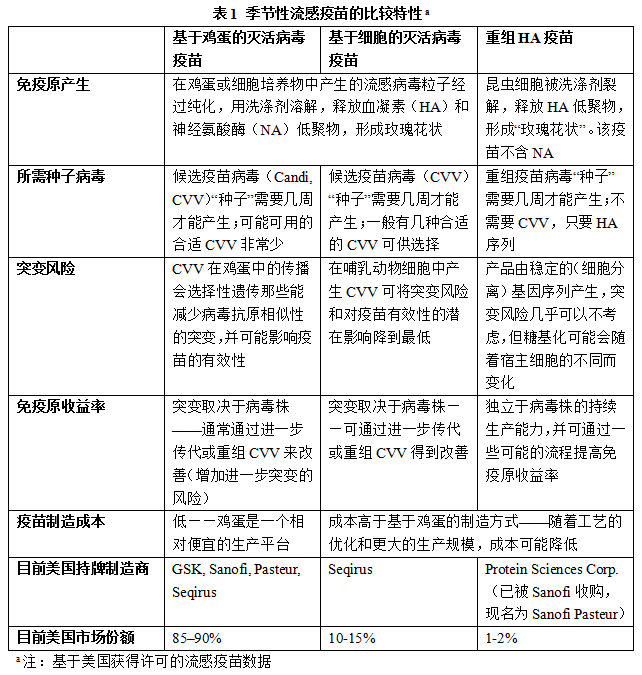
疫苗接种仍然是预防目前在人类中同时传播的四种不同的甲型和乙型流感病毒引起的发病率和死亡率的最佳有效干预措施。2017-2018年流感疫情期间,针对A(H3N2)的临时疫苗有效性(vaccine effectiveness, VE)低于此前北半球中期报告中多年来的VE汇总估计值,包括来自美国、加拿大和欧洲针对19-64岁成年人的结果,2017年澳大利亚流感季中也观察到了同样的低VE。低VE的原因通常被认为是疫苗病毒与不断进化,携带逃脱宿主免疫的突变的致病病毒之间的病原差异。然而,尽管在2017-2018年流感季占主导的A(H3N2)亚型病毒包含许多HA基因支系,但并未检测到与A/Hong Kong/4801/2014类似的细胞传播参考病毒(包括一个最优化的疫苗病毒株)之间存在明显的抗原漂移。然而,从10月到2月初在美国共同传播的A(H3N2)病毒中,针对适应性病毒(用于在鸡胚蛋中生产流感疫苗用的病毒)的抗血清对其中36%的病毒的抑制作用减弱。来自欧洲的A(H3N2)病毒也有很高的比例在抗原上与基于鸡蛋的疫苗参考病毒不同。此外,只有一小部分A(H3N2)分离株可以通过血凝抑制试验进行表征,其它病毒必须通过病毒中和等其它方法进行分析。2017-2018年VE降低的多重因素之一是病毒血凝素(HA)在鸡蛋中分离、适应和繁殖后发生的变化,而鸡蛋是目前全球使用的疫苗制造系统的基础(表1)。
2017-2018流感季中分发的流感疫苗使用的种子病毒是从人体中分离出来的,在实验室重组后,在鸡蛋中传播时会诱导三个氨基酸替换HA(n96 L194P和T160K,导致158残端缺少糖基化),以及一个额外的225位置的氨基酸替换(从天冬氨酸替换成甘氨酸)——这是大规模疫苗生产的必要条件。尽管许多其它的卵细胞适应病毒已被世卫组织流感合作中心(WHO Collaborating Centers for influenza,WHO-CC)分离并检测,但它们也有其它HA突变,这些突变对抗原特性产生了巨大的影响,而这些突变并没有被鉴定。几项研究假设某些鸡蛋适应性突变似乎改变病毒抗原性,因此可能是疫苗VE低下的部分原因。几十年前,科学家便认识到了在鸡蛋中传播的人流感病毒发生的HA变化,但WHO-CC通过识别最优化的鸡蛋适应病毒株,在很大程度上避免了这些疫苗抗原性变异的有害影响。然而,近年来,A(H3N2)亚型病毒的进化导致基于鸡蛋的疫苗的有效性低下。这一挑战进一步推动了扩大疫苗生产的替代宿主系统(细胞疫苗或重组蛋白疫苗)的研发。现在这些系统同时启动,以加强对季节性流感和大流行性流感紧急情况的公共卫生准备(表1)。
基于细胞的和重组流感疫苗
FlucelvaTM最初以一个源自细胞的灭活病毒三价疫苗(ccIIV3)(最初使用蛋类来源的种子病毒进行生产)获得批准的,在一个合格的哺乳动物细胞系(33016PF Madin-Darby Canine Kidney (MDCK)细胞)中传播,并于2012年由诺华疫苗和诊断公司(2015年,bioCSL收购了诺华流感疫苗这一块的业务,并创建了总部设立于伦敦的Seqirus公司)获得许可。该三价疫苗于2016年升级为四价疫苗(ccIIV4(Flucelvax)),并获得FDA的许可。然而,这两种疫苗都是由鸡蛋衍生的病毒种子生产的,因此,鸡蛋适应相关的突变可能仍然存在于疫苗抗原中,而且效果可能类似于已获许可的基于鸡蛋的疫苗。2016年8月,Seqirus获得FDA补充批准,可使用两个WHO-CC机构(美国疾控中心和澳大利亚维多利亚传染病参考实验室(Victorian Infectious Diseases Reference Laboratory))提供的MDCK细胞中分离和传播的CVV进行ccIIV4的生产。因此,在2017年秋季,美国首次向数百万人接种了季节性流感疫苗(fluelvax四价),该疫苗包含一种纯哺乳动物细胞培养衍生的甲型流感A(H3N2)病毒,作为其四种成分之一。FDA基于医疗保险服务中心(Centers for Medicare Services)的健康保险索赔数据进行的相对有效性的初步估计表明,在65岁及以上的受试者中,相比于基于鸡蛋的疫苗,ccIIV4的有效性更高。
在疫苗中使用一种完全由细胞培养而来的病毒,这种病毒在任何阶段都没有在鸡蛋中繁殖,这是2007年开始的10年努力的成果。2007年,诺华疫苗和诊断技术公司(现在是Seqirus)与美国的WHO-CC、总部位于墨尔本的WHO-CC合作,随后又与伦敦和东京的WHO-CC合作,达成了几项研究协议,部分得到了美国卫生与公众服务部(US Department of Health and Human Services, HHS)的支持。在这些协议中,诺华公司的专有33016PF MDCK细胞株——曾用于疫苗生产的合格试点细胞,被转移到各个WHO-CC,一同转移的还有包括从病人身上获取病毒,转入细胞,再从细胞中分离病毒,进而传播,表征,最终实现基于细胞的疫苗生产等流程在内的一整套标准化操作方案。
这些早期研究表明,与鸡蛋相比,33016PF细胞中甲型流感病毒A(H3N2)的分离率要高几个数量级,同时避免了人类流感病毒在鸡蛋中传播时发生的鸡蛋适应性突变。由于明确的实地比较试验尚未公布,完全来自于哺乳动物细胞的季节性流感疫苗相比于来自鸡蛋的疫苗的有效性的优势还尚未明确,但动物和人类血清学测试表明,来自哺乳动物细胞的抗原(尤其是包含A(H3N2)和B病毒成分的疫苗)的保护效果更佳,至少在某些流感季中的确如此。
2013年FDA批准的FlublokTM(Protein Sciences公司,最近被赛诺菲巴斯德(Sanofi Pasteur)收购)是一种仅由流感重组HA组成的疫苗(重组流感疫苗, RIV),该疫苗使用杆状病毒过表达,并从受感染的昆虫细胞培养物(Spodoptera frugiperda, 草地夜蛾)中纯化而成。RIV包含WHO推荐的基于细胞的疫苗原型病毒HA外域的氨基酸序列。此外,RIV的制造不包括化学病毒灭活处理,从而避免了灭活处理对疫苗抗原的潜在影响。并且与IIV相比,RIV的HA蛋白浓度增加了三倍。在一项针对50岁及以上成年人的随机对照试验中,与经许可的基于鸡蛋的四价疫苗相比,RT-PCR实验证实,RIV4在预防甲型流感方面的有效性提高36%(95%置信区间(CI): 14-53%),总体有效性提高30%;2014-2015年试验中发现的甲型流感病毒中80%为H3N2株。不幸的是,很难区分疫苗的高HA抗原含量和/或缺乏鸡蛋适应性变化对较高相对效力的各自贡献。
考虑到VE证据的不足和观察性研究的局限性,目前需要尽快进行更大规模、更严格的试验。未来测量RIV4 VE的机会受到美国生产和分销水平的限制,目前这两块的不完善导致难以通过已建立的有效性监测平台评估新疫苗的性能。在2016-2017年的美国流感季,即使VE值小幅上升5-10个百分点,也能预防49.4万- 98.2万人患病,以及11.5万-22.8万人住院。虽然还需要进行进一步的研究,以更充分地评估基于细胞的疫苗在减轻流感疾病负担方面的潜在益处,但最终将需要进行更具变革性的产品开发,以实现流感疫苗的总体最佳效力。通过细胞和/或重组制造平台获得的VE中期收益可以在许多方面得到进一步利用,包括(1)使用如MF59®等佐剂的制剂来增强免疫反应和保护效果,FluAd的研究证明了这一点;(2) FluzoneTM高剂量研究表明,更高的抗原剂量配方可增强免疫原性和有效性;(3)烟草植物可能成为新的疫苗生产系统(正在等待关键的临床研究结果);(4)目前基于细胞的疫苗只包含4种病毒中的1种,包含多种病毒成分的疫苗仍然只能在鸡蛋中生产。
产品特异性监控疫苗有效性
观察性流感VE研究对于评估疫苗在“真实世界”中的性能,提供疫苗监管、政策和产品开发方面的信息至关重要。然而,目前支持观察性流感VE研究的数据流并没有产生针对疫苗产品的特定信息,因此不足以评估2017-2018年在美国分发的11种疫苗的相对有效性。尽管与传统的基于鸡蛋的流感疫苗相比,RIV和ccIIV可能提供更好的保护,但到目前为止,这些疫苗的稀缺性使用并不允许使用现有的观察性研究来支持优先使用哪一种流感疫苗。当前流感季关于流感疫苗有效性的临床资料的稀缺已成为关注的焦点。FDA最近公布了一项研究的初步结果,该研究旨在评估ccIIV和基于鸡蛋的疫苗对65岁及以上人群的相对有效性。另外两项由BARDA和美国国防部赞助的正在进行的研究预计将分别为4岁至64岁或4岁以上的受试者提供ccIIV和基于鸡蛋的疫苗的绝对和相对有效性数据。
改进的季节性流感疫苗的开发将依赖于创新的临床研究,评估产品特异性或平台特异性VE之间的差异,从而产生证据,告知制造商、监管机构、公共卫生决策者和消费者哪个产品、哪类平台的疫苗VE更高。随着新疫苗的不断增加,我们需要重新评估新产品,并需要更好的方法来监控和比较产品,包括扩大当前的临床研究和网络,协调数据收集,允许个人数据分析和荟萃分析相结合,以及设计前瞻性随机设计,以提供一个健壮的基础支持短期和长期研究,最终减少季节性流感和大流行性流感的公共卫生影响。
公私伙伴关系的作用
2006年颁布的《流行病和灾害性应急准备法案》(The Pandemic and All-Hazards Preparedness Act)授权HHS建立灵活的公私伙伴关系(public–private partnerships, PPPs),通过开发包括疫苗、药物、呼吸器和诊断在内的创新医疗产品,实现防范流行病目标。季节性流感和大流行性流感的预防和应对是密不可分的,因为对季节性流感病毒的防备是防备流感大流行的基础。从2006年开始,HHS与多家公司签订合同,建立流感疫苗生产能力,以支持大流行疫苗的应对能力。该计划的两大重点是通过建立必要的基础设施,开发基于细胞和重组蛋白的疫苗。
2007年,诺华疫苗和诊断公司与美国疾病控制与预防中心WHO-CC签署了一项合作研究与开发协议,支持使用来自细胞的种子病毒在细胞中生产流感疫苗。诺华与伦敦、墨尔本和东京的WHO-CC也达成了类似的协议。这些合作的目的是建立实验室方案和工作流程,以优化适合开发种子库的病毒分离方法,以便在符合cGMP FDA指南的质量体系下生产疫苗。自合作协议开始以来,位于亚特兰大和墨尔本的WHO-CC已分离并鉴定了数百种病毒的特征,以产生支持FDA最近批准所需的证据基础。一系列MDCK和其它制造业细胞系都被测试,以确定最适合的细胞,该细胞必须能在不添加外来试剂的情况下接受临床标本分离的流感病毒,保留病毒原始的基因和抗原特征,并产生足够的种子病毒,实现在鸡蛋和细胞中的大规模生产。由诺华疫苗和诊断学公司开发的33016PF MDCK细胞系被认为是所有被评估的细胞系中最适合的。尽管CDC和墨尔本WHO-CC正在使用33016PF MDCK细胞株,但东京WHO-CC开发了自己的合格MDCK细胞株,为制造商提供CVV。这样的合作是长期项目伙伴关系的最新例子,为了满足季节性流感两年性的疫苗需求周期,这种项目伙伴关系是必要的,目前这种合作推动了非基于鸡蛋的疫苗的许可证的颁发。基于细胞和重组蛋白的疫苗技术提供了更大的灵活性,可实现比鸡蛋生产的疫苗更有效的潜力,同时可能支持加快疫苗成分更新的时间表,以跟上流感病毒的快速进化,或对未来不可避免的大流行作出反应。公私伙伴关系是很好的例子,说明了HHS在促进流感疫苗改进的同时建立可持续大流行防备的战略。在2017-2018年的流感季中,符合上述理想特性的细胞重组疫苗在使用的所有疫苗中的占比仅为大约13%(ccIIV)和1% (RIV),毕竟只有当证据足以证明新一代疫苗的VE更高的情况下,新一代的疫苗才会被广泛使用。
即使考虑到A(H3N2)亚型的优势,2017-2018年北美和其它地区流感的严重程度也高于预期。最近上市的创新疫苗是业界和公众伙伴为使流感疫苗生产平台多样化而进行的十年努力的成果。新的非基于鸡蛋的疫苗生产平台是近期才被认可的一个里程碑,因为这些疫苗已经被分发给美国数以百万计的人。ccIIV4这项工作未来的一个主要突破在于:4种流感病毒成分都来自于获得最大免疫原,且不携带宿主选择突变的生产系统。在2014-2015年流感期间,主要针对H3N2亚型的RIV具有更高的相对疗效,这一结果令人振奋。我们鼓励对其它病毒亚型和在其它流感季的疫苗相对有效性进行更多的观察。通过采取了上述每一个切实可行的步骤,预计季节性流感疫苗的效力随后将会提高。然而,宿主相关免疫因素方面的研究,如先前接触的影响和随后疫苗反应的免疫,也可能导致改善流感VE的策略。在我们等待能提供广泛和持久保护的新一代流感疫苗(如通用性疫苗)的开发和供应的同时,继续改进现有和替代平台是一项重要的公共卫生优先事项。
原文检索:
Ian G. Barr, Ruben O. Donis, David E. Wentworth et al.. (2018) Cell culture-derived influenza vaccines in the severe 2017–2018 epidemic season: a step towards improved influenza vaccine effectiveness. NPJ Vaccines,3: 44.
张洁编译