结核分枝杆菌复合体的生态和进化
过去200年,有10亿人因结核病(TB)而死亡。 直到今天,结核病仍然是造成死亡人数最多的传染病,WTO估计每年有1040万新发结核病患者,每年有170万人因结核病而死亡。此外,研究人员估计全球四分之一的人已经被结核菌潜伏感染,从而成为潜在活动性结核病患者。目前阻碍全球结核病防控的障碍有三个:1) 结核病的诊断在很大程度上仍然依赖于120年前所开发的、低灵敏度的涂片显微镜检查技术;2) 结核病的预防仍然依赖于100年前所开发的、效果有限的卡介苗(Bacille Calmette-Guérin, BCG);3) 结核病的治疗仍然依赖于已有40至60年历史、治疗效果有限,并且抗药性越来越严重的抗生素。在这一背景下,多重耐药性(multiple-drug resistance, MDR)和广泛耐药性(extensive-drug resistance, XDR)结核病已成为日益严重的问题。另外,结核病合并HIV感染和结核病合并2型糖尿病等也都助长了结核病肆虐。除了过时的诊断、预防和治疗工具之外,各种教条主义也阻碍了结核病领域的发展。例如,一些科学家认为耐药结核菌对机体的适应性不如药物敏感菌株;一些观点认为结核菌作为一个物种,不同菌株之间并不存在基因型和表型的变异。人类结核病主要由结核分枝杆菌复合体(Mycobacterium tuberculosis complex, MTBC)的成员引起。MTBC是一组序列相似性非常高(> 99%的核苷酸序列一致性)的抗酸杆菌。与其它细菌相比,MTBC成员间几乎没有序列变异,所以多位点序列分型的用途有限,因此MTBC成员之间的生态学和进化关系仍有待进一步探讨。新一代测序技术的发展可让我们克服以往方法的局限性,在全基因组水平上观察MTBC成员细菌的多样性,从而详细分析MTBC成员细菌多样性的进化推动力。
1. 分枝杆菌的系统发育
分枝杆菌属(Mycobacterium)内有170多种细菌,其中大多数是环境微生物。一般来说,分枝杆菌属内的细菌可被分为快速生长菌(fast-growers)和慢速生长菌(slow-growers),其中可感染人类的三种分枝杆菌病原菌,包括MTBC、麻风分枝杆菌(Mycobacterium leprae)和溃疡分枝杆菌(Mycobacterium ulcerans)属于慢速生长菌。此外,一些所谓的非结核分枝杆菌(non-tuberculous mycobacteria, NTM)可以导致免疫力低下或免疫受损的人发病,这些杆菌包括快速生长的脓肿分枝杆菌(Mycobacterium abscessus)和慢速生长的鸟分枝杆菌(Mycobacterium avium)、海分枝杆菌(Mycobacterium marinum)、蟾蜍分枝杆菌(Mycobacterium xenopi)、戈氏分枝杆菌(Mycobacterium gordonae)和堪萨斯分枝杆菌(Mycobacterium kansasii)。然而,适应了人类的MTBC是一类独特的致病菌。作为人类的专性致病菌,这种MTBC并没有任何环境宿主或动物宿主,完全依赖于人—人传播。与其它病原菌不同的是,它们的毒力和传播力并无直接联系。MTBC是如何进化为如此成功的病原菌的呢?
1.1 从环境微生物到专性致病菌
目前的观点是MTBC通过不断适应细胞内环境,逐步从环境微生物进化为专性致病菌。该进化过程的一个关键步骤是MTBC的祖先获得了在原生动物体内存活的能力,这样结核菌便可进一步感染哺乳动物的巨噬细胞并在其中繁殖。另一个关键的进化步骤是获得了人传人的能力。当人类患结核病后,感染者咳嗽出的空气飞沫便可导致结核菌的传播。在原始社会,人类篝火社交以及因烟所导致的肺部损伤可能在结核病传播和进化过程中起到促进作用。
导致MTBC的祖先微生物转变为专性致病菌的遗传因素是什么?非结核分枝杆菌中的M.marinum和M. kansasii与MTBC在基因组水平上有着较高的相似性。将它们与MTBC的基因组进行比较研究后,研究人员发现MTBC删除了一些不必要的基因,例如与致病性无关的基因;并且通过水平基因转移(HGT)获得了新基因。MTBC的基因组长度是4.4 Mb,小于M. marinum和M. kansasii的基因组(分别为6.6 Mb和6.4 Mb)。同时,MTBC的祖先自从和M. marinum和M. kansasii在进化上分离后,通过HGT又获得了数百个基因,其中包括转移酶基因以及与适应厌氧条件相关的基因。让科学家疑惑的是,这一结果还发现MTBC的许多已知毒力因子在NTM的基因组中也存在,如PhoPR双组分系统、DosR / S / T调节子、mce相关基因和ESAT6分泌系统。同样的两类虽然功能未知,但被预测与致病性和胞内存活有关的蛋白质家族PE(proline-glutamic acid)和PPE(proline-proline-glutamic acid)蛋白家族也存在于非致病性的NTM中。PE_PGRS(PE_polymorphic guanine-cytosine-rich sequence)蛋白亚家族则仅仅存在于致病性的分枝杆菌中,包括M. leprae、M. marinum、M. ulcerans 以及MTBC。MTBC基因组内含有大量毒素-抗毒素系统基因,这与另外的细菌形成鲜明对比。其中的一些毒素-抗毒素系统已被证明在临床菌株中的表达有差异。毒素-抗毒素系统与细菌的许多功能,包括基因表达调控、生长速率和持留性有关,说明这些系统可能在MTBC的致病性上扮演重要角色。综上,比较基因组学的结果表明,并不能从基因组上寻找出单一的特征来解释MTBC对人体的毒力和传播能力。
1.2 与Mycobacterium canettii的比较基因组学
将MTBC菌株和M. canettii以及另外的光滑结节细菌(smooth tubercle bacilli, STB)进行基因组比较,也可揭示MTBC作为专性致病菌的特点。STB在系统发育上和MTBC最为接近(图1a)。到目前为止,已有近100株STB被分离,它们都来自非洲。至今尚未有STB人传人的病例记录。科学家对STB的流行病学仍然知之甚少。STB在儿童中的致病性似乎比成人的大。这都说明STB和环境条件致病菌的致病特征类似。与MTBC菌株的基因组相比,STB的基因组要大10-115kb。菌株之间的在核酸水平上的变异性更大。例如,MTBC菌株彼此大约相差约2,000个SNP,而STB菌株则可相差多达65,000个左右的SNP。更为重要的是,STB的变异与HGT有关,但MTBC则没有这一特征。这说明STB在进化上与其它分枝杆菌是相似的。对MTBC、STB以及NTM的基因组比较显示,参与维生素B12合成的基因cobF并不存在于MTBC,但是存在于STB以及NTM,如M. marinum和M. kansasii中。这表明MTBC可能无法合成维生素B12,必须从宿主中摄取。另一方面,MTBC中存在一种与宿主免疫调节相关的蛋白pe_pgrs33,但在STB、M.marinum和M. kansasii中缺失,这说明MTBC中存在与致病性相关的基因。最近的研究表明,MTBC中存在两个拷贝的聚酮合酶pks5基因,这种基因重组事件导致细胞壁的变化,这与菌株的毒力增加有关。以上的比较基因组学研究表明,MTBC和许多其它的致病菌不同。一些致病菌的致病性可以与少数的染色体岛或毒力质粒相关联。但在MTBC中,细菌毒力和传播机制的决定因素更为复杂,是多种因子相互作用的结果。另外,一些细菌因子还和宿主因子相互作用,导致MTBC不同成员具有不同的宿主偏好、不同的感染表现和结果。
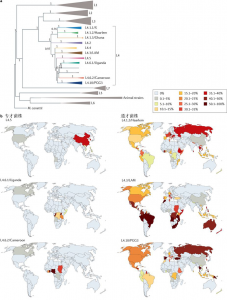
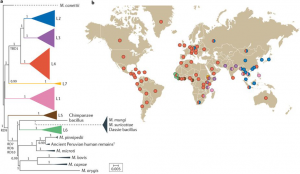 图1 人类适应的MTBC的全球系统地理学。a.基于基因组的MTBC以及Mycobacterium canettii的系统发育进化树。MTBC包括7种适应人类的谱系(彩色)和几种适应各种野生和家养动物(灰色)的谱系。M. tuberculosis特异性的缺失(TBD1)存在于L2、L3和L4谱系的所有菌株基因组上。类似地,在相应分支下的菌株基因组上都缺失差异区域RD7、RD8、RD9或RD10。黑色短箭头表示从来自秘鲁的考古遗体中回收的大约1,000年前的古老MTBC菌株的基因组。比例尺表示每个位点的核苷酸取代数。 b.7个主要适应人类的MTBC谱系的全球分布。
图1 人类适应的MTBC的全球系统地理学。a.基于基因组的MTBC以及Mycobacterium canettii的系统发育进化树。MTBC包括7种适应人类的谱系(彩色)和几种适应各种野生和家养动物(灰色)的谱系。M. tuberculosis特异性的缺失(TBD1)存在于L2、L3和L4谱系的所有菌株基因组上。类似地,在相应分支下的菌株基因组上都缺失差异区域RD7、RD8、RD9或RD10。黑色短箭头表示从来自秘鲁的考古遗体中回收的大约1,000年前的古老MTBC菌株的基因组。比例尺表示每个位点的核苷酸取代数。 b.7个主要适应人类的MTBC谱系的全球分布。
图片来源:https://www.nature.com/articles/nrmicro.2018.8/figures/1
2. 寄主取向与适应
MTBC与其它致病菌不同,其它致病菌感染第二宿主时,可能仅仅是致病菌生活史中的偶然溢出事件,并不能在第二宿主上维持感染。然而,当MTBC的祖先菌株进化为专性致病菌后,可进一步进化为适应各种野生或家养哺乳动物以及人类的各种谱系(图1a)。人类结核病主要由狭义上的结核分枝杆菌(M. tuberculosis sensu stricto)和非洲分枝杆菌(M. africanum)引起。MTBC中可以适应人类的菌株可以进一步分为7个系统发育谱系。其中L1、L2、L3、L4和L7属于M. tuberculosis sensu stricto。L5和L6一般被称为M. africanum West Africa 1和M. africanum West Africa 2(图1a)。这7种谱系菌株表现出强大的系统地理种群结构,其中一些谱系在全球流行,而另一些则有强烈的地理限制(图1b)。L2和L4是全球普遍流行的谱系,其中L2主要在东亚占主导地位。L1和L3主要在印度洋周围地区流行。L5和L6的流行区域被限制在西非。而L7谱系则几乎全部在埃塞俄比亚被发现。各种因素相互起作用促成了适应人类的MTBC谱系成员的系统地理分布。在MTBC中适应动物的菌株中,有些早已被发现,有些则是最近才被发现。直到现在适应不同动物的MTBC菌株的生态、宿主偏好、进化以及它们与适应人类的MTBC菌株之间的关系仍然没有被透彻了解。
1896年,在Robert Koch发现可感染人类的结核分枝杆菌14年后,Theobald Smith证明产生动物结核病的致病因子是与结核分枝杆菌不同的细菌——牛分枝杆菌(M. bovis)。做为牛的病原菌,M. bovis也从许多哺乳动物,包括人类中被分离出来。人类可能仅仅是M. bovis的溢出宿主,这是因为人类结核病中只有1-3%的病例是由M. bovis和山羊分枝杆菌(M. caprae)感染而导致的,且这种结核病很少人传人。另一方面,野生獾对M. bovis高度敏感,因此它可能是M. bovis的稳定宿主,代表了一个重要的细菌库。其它适应动物的MTBC成员包括M. microti(感染田鼠)、M. pinnipedii(感染海豹和海狮)、M. orygis(感染羚羊)、M. mungi(感染带状猫鼬)、M. suricattae(感染猫鼬)、蹄兔杆菌(The dassie bacillus)以及黑猩猩杆菌(The chimpanzee bacillus)。这些致病菌都是根据所分离时的第一只动物宿主所命名的。这些谱系之间存在密切的系统发育关系(图1a),所以它们其实更适合作为MTBC中的不同生态型。另外,一些细菌的实际宿主仍不明确。正因为如此,决定MTBC不同菌株宿主范围的分子机制也不清楚。
在M. microti、M. mungi和蹄兔杆菌的基因组中缺少RD1。RD1可编码ESX1分泌系统,是M. tuberculosis sensu stricto完全毒力所必需的。RD1的缺失首次在M. bovis减毒疫苗BCG基因组中被发现,这一片段的缺失与BCG的毒力降低有关。据推测,RD1在M. microti、M. mungi和蹄兔杆菌中的缺失有助于它们对宿主的适应性。因为这些细菌主要感染生活在拥挤环境中的穴居动物,不良的通风环境使得菌株的传播更容易,于是便不需要RD1所提供的毒力了。另一项研究则研究了双组分调控系统PhoPR的突变表型,这一突变在所有适应动物的菌株和适应人类的L6谱系菌株中都存在。研究者发现,这种突变如果被移植到结核菌上将会导致PhoP调节子活性的下调,参与细菌毒力的生物活性脂质丧失以及ESAT6分泌减少。以上基因型如何导致M. bovis难以感染人类,研究人员目前仍不清楚。类似地,M. tuberculosis sensu stricto感染牛时也表现出减毒特征,这种宿主偏好的分子基础研究人员也不清楚。
3. 适应人类的MTBC的起源
由于M. bovis具有比M. tuberculosis sensu stricto更广泛的寄主范围,因此科学家最初认为结核分枝杆菌是人类在新石器时代期间从家畜中获得的。后来,细菌基因组测序发现M. bovis具有比结核分枝杆菌更小的基因组,这表明结核分枝杆菌不太可能从M. bovis进化而来。一些研究表明,MTBC各成员的基因丢失顺序正符合人类将结核病传染给动物的进化过程。比较基因组学研究也支持这一说法,因为适应人类的MTBC比适应动物的成员在系统发育上更古老(图1a)。最初的研究认为缺少RD7、RD8和RD10的细菌群就是适应动物的MTBC成员。但最新数据表明适应动物的MTBC可分为两个独立的系统发育分支(图1a)。其中一个分支内包括M. bovis、M. caprae、M. orygis、M. pinnipedii和M. microti。另一个分支则包括M. mungi、M. suricattae、蹄兔杆菌和黑猩猩杆菌,这一分支的细菌和结核分枝杆菌L6谱系拥有共同的祖先。在一些西非国家,结核菌L6谱系能导致高达50%的人类患结核病。由于L6谱系与适应动物的MTBC菌株有密切的系统发育亲缘关系,因此科学家猜测L6谱系的结核菌还拥有动物宿主。然而,到现在为止尚未发现这类菌株的动物宿主。考虑到L6谱系结核菌的系统发育位置(图1a),它可能在进化过程中发生了多次宿主跃迁,从人类跳到动物然后再回到人类。
现在的观点认为适应人类的MTBC起源于非洲。第一,STB被认为是MTBC亲缘关系最近的细菌,它们几乎全部在非洲被分离。第二,非洲是唯一拥有所有7种适应人类的MTBC谱系的大陆(图1b),并且这种大陆上结核菌谱系的多样性随着与非洲距离的增加而减少。第三,MTBC全基因组序列的各种系统地理学分析表明非洲是最可能的起源区域,并且还在非洲发现了可适应大多数动物、并可感染野生动物的MTBC成员(图1a)。与其地理来源不同,目前科学家还不能正确推算MTBC共同祖先的年龄。不过已经有多个研究组使用不同的方法来确定MTBC的系统发育年龄,但这些方法产生了不同的结果。为了能够探索MTBC的进化历史,需要对更为古老的M. tuberculosis进行基因组分析,以便为MTBC建立强大的适用的碱基替换率。
4. 适应人类的MTBC的生态学
一些适应人类的MTBC谱系仅出现在某一地理区域内(图1b),它们可能更喜欢感染当地人类。局部适应是指适应某种宿主的病原体在其它宿主中传播能力降低的现象。这类结核菌可能就是对当地人类进行了局部适应。已有研究发现,结核菌L5谱系的传播与患者的种族相关。另外,流行病学研究也发现人类结核病的局部适应现象。如,在大城市中某些菌株中却优先感染来自某一地区的患者。
4.1 “通才”和“专才”
从生态学的角度看,分布范围受限的MTBC谱系是可以感染特定宿主的占据狭窄生态位的专才。相反,分布广泛的MTBC谱系则是可以占据多种生态位的通才。MTBC L4谱系是全球范围内最常见的结核病传染源。然而最近的全基因组研究表明L4谱系仍可被分为多个亚系(图2a)。对来自100个国家的3,366个L4谱系临床分离菌株进行基因分型后发现,某些亚系在全球范围广泛分布,它们是通才,而其它亚系则是受地理限制的专才(图2b)。有趣的是,尽管大部分的MTBC上已知的人类T细胞表位是保守的,但是L4谱系中的通才亚系菌株的T细胞表位具有比专才菌株更大比例的可变性,这可能和多样的宿主范围和针对它们的免疫逃逸机制相关。在一些地区,通才型的MTBC菌株和专才型的菌株的交叉存在并不排斥,原因可能是创始人效应(founder effects)和有限的群落移动性。科学家认为专才型结核菌要比通才型菌株更古老,它们主要是没有足够的时间和能力在全球传播。研究人员还需要开展进一步的功能研究,来判定不同谱系结核菌适应不同人类宿主的主要原因到底是生物还是社会因素。
4.2 适应人类的MTBC的毒力进化
人类结核病的一个重要特征是潜伏性,可以潜伏长达十年。在此期间,结核菌会被宿主免疫系统抑制,直至免疫功能低下时,才大量繁殖导致人体发病。科学家认为MTBC菌株最早适应了以狩猎为生的人群,这样致病菌便可在潜伏十年后,在人类生命晚期发病,然后从感染者传播至免疫力低的新生儿。这样结核菌所面临的环境压力就小很多。根据生态学理论预测,人群密度随着城市化不断增长,与此同时增强了结核菌的毒力、缩短了潜伏期。适应不同人类的MTBC谱系在毒力、疾病发展以及传播潜力等方面都存在差异,而这些表型差异可能正与它们不同人类宿主的人口变化历史密切相关。另外,现在的数据显示人群中有着大量的潜伏感染者,而结核病病例则少得多,这说明结核菌的潜伏感染可能是一种菌和人体的共生关系,在某种程度上对宿主有利。例如结核菌潜伏感染可以给宿主提供免疫刺激以保护宿主免受其它疾病的困扰,结核菌还可以给宿主提供重要的微量营养素。
图2 MTBC L4谱系可以分为专才菌株和通才菌株。a.基于基因组的系统发育显示L4可以进一步细分为至少十个亚系。三角形表示对谱系和亚系列中的分支进行了折叠,以提高清晰度。b.L4谱系中的一些亚系在地理上受到限制,而其它亚系则分布在全球范围内(通才)。 百分比表示在给定国家中该亚系在L4谱系中的比例。
图片来源:https://www.nature.com/articles/nrmicro.2018.8/figures/2
5. MTBC菌株保守型基因组
5.1 HGT在MTBC中基本可忽略不计
HGT是否在MTBC临床菌株之间发生,还是只存在于STB和其它分枝杆菌菌株中?对这一问题存在争论。迄今为止大多数证据都认为HGT在结核分枝杆菌中未被检测到。对分布在MTBC菌株基因组上的小卫星重复序列进行分析,发现在不同菌株中这些重复序列是连锁的,没有被基因重组所破坏;用于进行MTBC菌株分型的基因组缺失无同源性;用不同的分子标记构建MTBC菌株的系统发育树,结果基本一致;除了与抗生素抗性相关的突变趋同进化以外,另外的单核苷酸位点的同源突变非常罕见。但最近的研究向这一理论提出了挑战,指出MTBC菌株经常交换小DNA片段,但由于序列变异有限,这些事件未被留意。总之,现有的实验认为MTBC是一类基因组保守的克隆子群体,HGT很少在菌株间发生。
5.2自然选择和遗传漂变之间的平衡
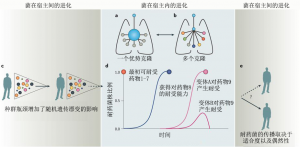
MTBC是一类基因组保守的致病菌,这对它们的分子进化有着重要的影响,特别是影响自然选择和中性进化(如随机遗传漂变)之间的平衡。在MTBC中,选择性牵连(selective sweeps)和背景选择(background selection)共同作用导致遗传多样性减少。在选择性牵连中,正选择的基因座(例如耐药突变)会导致整个染色体通过关联实现固定,多样性减少。背景选择则是当有害突变出现时,该基因座相关的所有染色体变异都被去除。MTBC群体遗传学的一个特征是高比例的低频变异,尤其是单体突变(即仅在一个菌株中发生的突变),这正是背景选择的结果。值得注意的是,低频突变的细菌在患者体内也被偏向选择,这表明纯化选择和背景选择可能是患者和MTBC共进化的特征。一项研究跟踪了治疗期间MTBC在人体中的种群变化,发现接受有效药物治疗的人体中结核菌的纯化选择信号要强于接受次优的抗生素治疗患者中的结核菌。总之,纯化选择似乎是MTBC进化的一个重要特征,并且这些细菌中出现的大多数新突变可能是有害的,这反映了适应人类的MTBC已经能很好地在人类中生存和传播(图3a)。
5.3 种群瓶颈、种群结构以及遗传漂移的影响
除了纯化选择之外,种群瓶颈也会导致结核菌多样性的减少,因为每次MTBC感染新宿主时,老患者体内出现的多数细菌变异都会丢失(图3b)。此外,MTBC的种群可分为不同亚群,这些不同亚群在同一宿主体内、在不同患者身上,以及在不同的地理环境下都存在(图1b)。传播瓶颈、种群结构和克隆性都会导致有效种群规模减少。种群规模减小将导致较低的自然选择效率,随机遗传漂移的影响也相应增加。它在MTBC的进化中起着重要作用。在MTBC中有2/3的SNP是非同义突变,甚至已被菌株固定下来的SNP。这些突变可以影响相应基因的功能。总之,理解影响结核菌进化的作用,有助于对MTBC的进化轨迹进行预测并对其进行有效的干预。
图3 自然选择和遗传漂变在MTBC进化和耐药性出现中的作用。
a.MTBC在宿主内的进化特征是纯化选择。在患者中有一个优势克隆,另外的多数突变在传染时会丢失。大蓝点表示主要的细菌克隆,小灰点代表新的突变。b.一些可导致肺部囊性纤维化的机会病原体,如铜绿假单胞菌或伯克霍尔德氏菌,它们往往在进化过程中是对人类宿主的从头适应,不同的细菌亚群在患者中可以分开进化。不同颜色的小点代表不同的细菌亚群。c.MTBC在每次传播时遇到种群瓶颈,这导致细菌多样性减少、有效种群减少,并导致随机遗传漂变对种群的影响增加。不同颜色的点代表在患者体内进化出的不同细菌突变体,大小说明不同菌株对宿主适合度的差异。d.在患者治疗期间,对结核菌增加另外抗生素后菌群的进化曲线。当给患者的用药不能杀死MTBC,患者处于无效治疗时,MTBC便有更大的可能获得额外的抗性突变。本图显示,某患者最初感染了已经对7种药物具有抗性的MTBC菌株。红点表示所感染菌株中的100%通过测序诊断都发现了这7种药物的耐药基因。在持续5年的治疗期间,此患者中所感染的细菌不断获得对几种其它药物的抗性,包括两种新的抗结核药物候选物bedaquiline和delamanid(蓝色的药物8和粉红色的药物9)。这些新的耐药菌在患者体内被固定下来。在此过程中可以出现多个独立的耐药菌亚群,其中一些可以在患者体内固定感染,而其它的亚群则随着时间的推移被患者丢失(如,对药物9产生的耐药菌变体A和变体B)。e.这些在患者体内固定感染的耐药菌被成功传播的可能性取决于耐药菌对环境的适合度以及偶然性。虚线箭头表示对环境适合度高,实线箭头表示对环境适合度低。
图片来源:https://www.nature.com/articles/nrmicro.2018.8/figures/3
6. 药物耐受
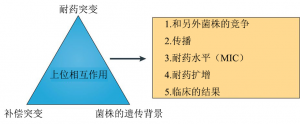
MDR-TB和XDR-TB的出现说明抗生素对MTBC有着正选择。在临床环境中MTBC菌株的突变率大约为每个基因组每年有0.3-0.5个碱基替换,这比大多数的临床细菌低几个数量级。但是,尽管结核菌突变率低且缺乏HGT和抗性质粒,耐药性仍然很快就会出现(图3d)。这是因为抗生素耐药突变的频率与固有突变率、耐药基因的大小、耐药突变的适应性效应和个体内细菌的种群大小都有关系。对于治疗失败的患者来说,体内细菌的种群可能非常大。耐药基因的大小与耐药机制有关,并因抗生素不同而不同。以上驱动结核菌耐药性的因素很容易被理解。相比之下,结核菌耐药性的生态和进化仍然需要研究。耐多药结核病和广泛耐药结核病的全球流行主要是由于耐药菌株的产生和直接传播(图3c-e)。MTBC中耐药基因的突变通常与无药物筛选条件时菌株适合度代价有一定联系,但是一些突变的产生对菌株没有增加或很少增加成本,那么这些突变则被菌株优先选择。此外,补偿突变也可以克服与特定耐药突变相关的初始缺陷(图4)。例如,在利福平抗性菌株中, RNA聚合酶(RNAP)亚基中的二次突变可以恢复菌株的转录活性,这种突变增加了耐药菌的传播能力,也有可能获得额外的抗生素耐受性。此外,对不同药物产生反应而导致的耐药突变之间具有上位相互作用,这将导致每个单独突变的适合度代价降低。最后,菌株的遗传背景也可以影响耐药途径,同一突变在不同的菌株上耐药水平可能不同。作为MTBC谱系L2的成员,结核菌北京菌株家族(图1a)和多药耐药有关,但原因尚不清楚。是否这一菌株有着更高的固有突变率仍不清楚。有研究认为这些菌株之所以获得如此广泛的传播可能是由于随机的遗传漂变,也就是说,在正确的时间出现在正确的地方(图3b)。也有一种可能,就是一些北京家族菌株的毒力和传播能力较强,这样就有更多机会产生耐药性,并更好地承担耐药突变的负担。总的来说,耐药突变、补偿性突变以及菌株的遗传背景之间的上位相互作用共同影响耐药结核病的生物学和流行病学(图4)。当制定结核病的新型治疗方案时,加深对这种相互作用的理解,将对改善结核菌的耐药性至关重要。
图4 上位相互作用在耐多药结核病进化中的作用。
图片来源:https://www.nature.com/articles/nrmicro.2018.8/figures/4
7. 结论
近年来,虽然人类结核病的起源、生态学和进化研究已经获得了许多新的见解,但仍有许多工作要做。MTBC通过获取和丢失基因从一种环境微生物进化为专业致病菌。但在MTBC基因组中并没有一个单一特征(例如基因或基因突变等)来解释这一类微生物的专性致病的生活方式以及各种MTBC谱系对不同宿主的偏好。对这些不同的MTBC谱系进行比较研究,例如比较它们的基因组、宿主偏好、致病能力和传播能力等,有助于我们了解结核菌致病性、传播能力和宿主决定的因素,对新型抗生素和疫苗的开发也有一定的促进作用。适应人类的MTBC呈现出特定的系统地理种群结构,并且不同的谱系有着不同的进化方向,有的进化为了专才,有的进化为了通才。但这一现象能否反映MTBC的适应性策略,还是仅仅是随机的创始效应,或仅仅是因为社会因素仍然不得而知。目前研究认为MTBC的种群中所进行的HGT基本可忽略不计。MTBC的严格克隆性、传播瓶颈以及种群结构都会影响自然选择和随机遗传漂移之间的平衡,但我们仍需要进一步的研究来理解不同的进化力量在患者内部和患者之间对菌株起作用的方式,以及不同的进化力量在结核菌上所起作用与其它病原体的不同。最后,耐药突变、补偿性突变以及菌株的遗传背景之间的上位相互作用可共同影响耐药结核病的生态学和进化。对这一现象的进一步研究,可帮助了解它们耐药菌产生中的重要性,以改善结核菌和其他细菌感染的治疗方案。
原文检索:
Gagneux, S. (2018) Ecology and evolution of Mycobacterium tuberculosis. Nature Reviews Microbiology, 16(4): 202-213.
Paul/编译