视网膜修复
视网膜受损时,视力会受到很大的影响。不幸的是,虽然全球有数亿人患有视网膜变性,但目前还没有有效的治疗方法。然而,随着干细胞技术的不断进步,新方法有望修复视网膜。无论是通过培养新细胞,然后将它们移植到视网膜中,还是通过从头开始构建整个视网膜,干细胞疗法有望提高视网膜变性患者的视力,还他们一个清晰的世界。
1. 新突破!干细胞修复视网膜
干细胞疗法初见成效
到目前为止,视网膜损伤已被证明是不可逆转的,但干细胞治疗可能是恢复视力的关键。
人类从外界获得的信息中有80%来自于眼睛。对于一个高龄老年性黄斑变性(advanced age-related macular degeneration, AMD)患者来说,日常生活是非常困难的。你可以尝试一下,眼睛聚焦在远处,仅使用周边视觉来读页面上的文字。晚期AMD患者看到的图像都是严重扭曲的,或者视力中心有大黑点,甚至无法完成阅读、烹饪或驾驶等日常任务。即使勉强能看到,也要耗费好大力气。由于AMD没有治愈方法,患者要在模糊中度过一生。
AMD是由视网膜(眼睛后方的薄层组织,负责将光转化为电信号,然后由大脑转化为图像)退化引起的一系列眼部疾病中最常见的一种。到2020年,全球约有1.96亿人将患上AMD。此外,还有数百万人罹患罕见的遗传性视网膜变性疾病,例如视网膜色素变性——一系列首先影响周边视力的疾病,常始于幼年时期。
鉴于视网膜变性极大地影响患者的生活品质,研究人员一直在努力解析视网膜变性的原因,并探索各种治疗方法以期恢复患者视力。
最有希望的疗法是基于干细胞的几种潜在治疗方法。干细胞具有全能性,能分化成各种细胞类型。目前几个植入自体干细胞以修复视网膜的方法已经开展了人体试验。今年3月,伦敦大学学院(University College London)和摩菲眼科医院(Moorfields Eye Hospital)的研究人员合作开展的伦敦治疗失明项目(London Project to Cure Blindness)宣布了一项试验结果,该试验中两名AMD患者使用了含有衍生自人体胚胎干细胞的视网膜细胞的生物工程贴片。
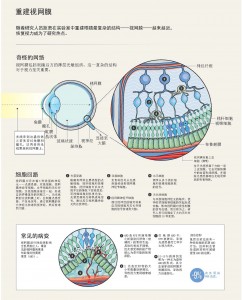
该贴片是通过诱导干细胞分化成视网膜色素上皮细胞而形成的。视网膜色素上皮细胞是形成视网膜和循环系统之间界面的单层细胞,并且AMD患者的视网膜色素上皮细胞存在严重损伤。然后,临床医生通过手术将贴片递送到患者视网膜的基部,希望这些健康的细胞能替换掉一部分受损的上皮细胞。两名受试者的手术均非常顺利,这与日本的类似试验一样。然而,与日本研究不同的是,伦敦项目的两位参与者都表示他们的视力有所改善,其中一位受试者从几乎无法阅读到每分钟能完成超过80字的阅读。
尽管这些试验规模太小而无法得出关于干细胞疗法是否能有效治疗AMD的确切结论,但这些发现为该领域注入了活力。随着干细胞培养技术的不断完善,研究人员不仅可以增加植入的细胞类型,而且可以构建整个功能性视网膜。这些系统可以成为药物发现和疾病建模的有力工具。在细胞组成和组织方面,研究人员已经构建了与人类视网膜具有惊人相似性的视网膜类器官。对于视网膜变性患者来说,未来开始变得更加清晰。
2. 重建视网膜
3. 干细胞-视网膜生物学
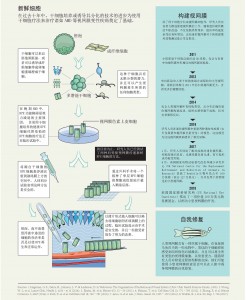
视力障碍影响全球超过2.85亿人。由于眼睛位于体表,动手术相对简单,眼科研究处于推进创新疗法的最前沿。
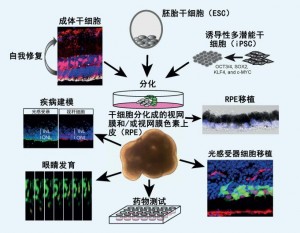
关于胚胎干细胞(embryonic stem cells, ESCs)和诱导多潜能干细胞(induced pluripotent stem cells, iPSCs)分化的开创性研究表明,干细胞可以分化为视网膜细胞和具有所有主要的视网膜细胞类型的三维视网膜类器官。这些技术进步为模拟人类视网膜发育和疾病,测试潜在的治疗药物和开发细胞移植治疗提供了宝贵的机会。
内源性视网膜干细胞、胚胎干细胞和诱导多潜能干细胞如何分化成具有广泛应用的视网膜细胞。
患者iPSC衍生模型的发展使我们能够探索遗传性视网膜营养不良的疾病机制,以及针对特定基因背景或细胞背景测试疗法。
我们使用患者iPSC衍生的视网膜色素上皮(retinal pigment epithelium, RPE)和视网膜类器官进行常见的RP2无义突变,引起X连锁视网膜色素变性,以测试促通读药物(translational read-through-inducing drugs, TRIDs)是否可以恢复RP2蛋白表达。一些遗传病由无义突变引起,无义突变通常导致翻译提前终止,生成截短、无功能的蛋白质,TRIDs可以解除无义突变导致的翻译停止,从而恢复蛋白质的合成。在iPSC衍生的RPE和视网膜类器官中,TRID恢复了RP2蛋白的合成,并足以逆转观察到的细胞表型,这表明TRIDs可以应用于临床视网膜营养不良基因的特异性无义突变。
CEP290突变能引起纤毛病综合征,同时也可引起Leber先天性黑蒙(Leber congenital amaurosis, LCA)。深度内含子突变是LCA的主要原因,它能刺激隐匿外显子的插入,导致翻译的提前终止。基于LCA患者衍生的iPSC得到的视网膜类器官,研究人员发现,最高水平的异常转录物,与光感受器分化和光感受器特异性外显子的剪接同时发生。这一结果表明,剪接的组织特异性差异可能推动了疾病的发生。反义寡核苷酸(antisense oligonucleotide, AON)药物能有效抑制隐匿外显子的插入,并改善正常剪接。CEP290蛋白表达足以挽救视网膜器官中的纤毛。这些数据表明,AON疗法可能是治疗CEP290-LCA的实用选择,AON疗法目前正处于CEP290-LCA的1/ 2期临床试验中。
细胞替代疗法可能为晚期视网膜变性患者带来福音。晚期患者的光感受器、RPE或视网膜神经节细胞(retinal ganglion cells, RGC)已经丢失。年龄相关性黄斑变性(Age-related macular degeneration, AMD)会诱发RPE和中心视力丧失,是导致失明的主要原因。研究人员在合成膜支架上开发了一种人源ESC衍生的RPE单层,作为移植的“贴片”,以替代丢失的RPE细胞。在此基础上,他们设计了1期临床试验,给两名患有急性湿性AMD的受试者植入贴片,以检验这一程序的安全性和可行性。在移植后12个月,有证据表明该贴片有效改善了两位受试者的视网膜功能和视力。该研究初步证实了ESC-RPE贴剂作为AMD潜在治疗的安全性和可行性。
在晚期AMD以及遗传性视网膜疾病中,患者的光感受器丢失。前期研究已经表明,来自供体组织的光感受器前体的移植可以恢复先天性静止性夜盲症(congenital stationary night blindness)模型小鼠的视觉功能。随着3D干细胞分化技术的进一步发展,研究人员用人类ESC也得到了类似的结果,并将这些技术应用于治疗晚期视网膜变性。
在低等脊椎动物中,视网膜中的米勒神经胶质细胞(Müller glial cells)具有干细胞特性,可以再生神经元。研究人员正在研究如何诱导人类视网膜中的这些细胞进行内源性修复,使其成为神经保护因子,或产生新的RGC以用于青光眼的移植手术。这些研究证明了干细胞的实用性,以及移植作为视网膜退化时恢复视力的治疗策略的可行性。在干细胞也可能成为基因编辑的移植细胞来源的情况下,这些研究尤为重要。
原文检索:
David Holmes. (2018) Retinal repair: visions of the future. Nature, 561: S1
David Holmes. (2018) Retinal repair: visions of the future. Nature, 561: S2-S3.
张洁/编译