遗传突变驱动新冠风险
图为COVID-19 患者在加利福尼亚州埃尔森特罗的重症监护室接受治疗。
基因组研究发现了新冠肺炎的遗传风险因素——并且可能为治疗方法提供线索。
自去年 3 月以来,世界各地的研究团队已经研究了超过十万名 COVID-19患者的基因组,希望找到遗传线索,以了解哪些人是重症新冠的高危人群。研究小组在7月8日发表在《自然》(Nature)杂志上的总结分析中指出,十几种基因突变与个体感染新冠以及发生重症新冠的几率有很强的统计关联。
加拿大蒙特利尔麦吉尔大学(McGill University)的传染病医生和遗传流行病学家 Guillaume Butler-Laporte指出,实际上有很多非常常见的突变在 COVID-19中非常重要,他们没想到会这么清楚地找到它们。
参与分析的团队包括学术实验室和私营公司,例如美国公司23andMe和AncestryDNA,并且在过去一年中一直在稳步发布他们的工作。这项计划名为新冠宿主基因计划(COVID-19 Host Genetics Initiative, HGI),于3月首次在 medRxiv预印本服务器上发布了成员的总结——在分析时涵盖了近五万名 COVID-19 患者的46项独立研究的合并。
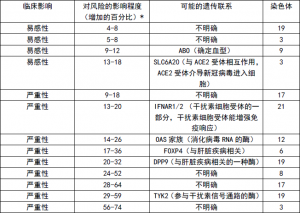
他们发现的遗传关联中的一小部分会增加患病风险,这其中一些基因对肥胖、糖尿病和其他疾病的贡献与其对新冠的贡献相当(表1)。
表1 新冠肺炎遗传风险因素
HGI 计划发现了十几个在统计上与SARS-CoV-2 易感性或重症新冠相关的基因区域。
* 在 HGI 总结中,风险估计是针对携带一个拷贝的风险基因的个体,并且是在具有不同纳入标准的组中确定的,因此可能有一些波动。其他研究给出了不同的估计。
英国爱丁堡大学(University of Edinburgh)的重症监护医师和遗传学家Kenneth Baillie指出,这些发现可以阐明这种疾病的生物学机制,并为测试哪些药物提供建议。在其他研究中,科学家们还挑选了罕见的基因突变——与最新 HGI 研究中列出的相对常见的变异形成对比——这些罕见基因可能更能说明严重疾病的根本原因。
并不是每个人都相信基因工作可以立刻提高人们对疾病的理解。英国牛津大学(University of Oxford)人类遗传学家Julian Knight表示,他们得到了一个非常好的基因图谱。若能利用这些信息找到合适的药物靶点,或增强对疾病变异性的理解,那将是重要的突破。这是试图将基因组中的常见变异与人们罹患复杂疾病的风险联系起来研究的典型事件。
deCODE Genetics公司的首席执行官兼 HGI 成员 Kári Stefánsson并不认为寻找遗传风险因素的工作特别富有成效——至少到目前为止是这样。尽管如此,Stefánsson 指出,他认为尽可能多地追踪这些基因可能是有意义的,这或许能够找到一个非常重要的机制。
麦吉尔大学(McGill University)的遗传学家和内分泌学家、HGI成员Brent Richards指出,尽管遗传学家还没有得到所有的答案,但他们已经非常迅速地找出与COVID-19相关的遗传因素。人类遗传学研究者们今年付出了大量的努力。
COVID-19 的基因风险因素
HGI的工作不像一个专注于单一目标的联盟,而更像是一个合作、支持和建议的交流中心。团队可以自由发表自己的研究,同时帮助汇总各个成员的成果。与遗传学家 Mark Daly 共同创立HGI的统计遗传学家Andrea Ganna表示,HGI的初衷只是创造一个让人们感到舒适并愿意合作的环境。两人都就职于赫尔辛基大学(University of Helsinki)和博德研究所(Broad Institute)。
Ganna是全基因组关联研究 (genome-wide association studies, GWAS) ——遗传流行病学的基础——的专家。GWAS研究在大量人群中发现了整个基因组中数十万个相对常见的单碱基DNA突变,以查看患有特定疾病或特征的人群是否富含这些突变。Ganna指出,人们不可避免地会将GWAS应用于COVID-19。
Baillie 团队确定了名为OAS(oligoadenylate synthase,寡腺苷酸合酶)的抗病毒基因家族可能与新冠相关,其他团队的研究也证实了这一点。OAS基因会激活消化病毒RNA的酶,导致肺部OAS1酶循环水平降低的突变会增加新冠感染、住院和重症的风险。大多数冠状病毒使用名为磷酸二酯酶(phosphodiesterases, PDE)的蛋白质来抵消这种保护机制,但 SARS-CoV-2不会产生 PDE。据Richards解释,所以这可能是新冠病毒一个致命的弱点。他知道有制药公司正在开发针对该靶点的新冠药物,但拒绝透露细节。Baillie提醒,根据遗传关联,磷酸二酯酶12抑制剂很有可能会增强天然抗病毒防御能力。
Baillie团队发现并在其他 COVID-19 GWAS中证实的另一种突变可以编码干扰素细胞受体的一部分。众所周知,干扰素能增强人体对病毒的免疫反应。由于这种抗病毒作用,早在这种遗传关联曝光之前,世界卫生组织赞助的“团结”(Solidarity)试验(WHO开展的全球性大型临床试验,旨在检测多项候选药物治疗新冠肺炎的效果)中的首批药物就包含了一种干扰素分子,但疗效不佳。Baillie指出,遗传预测可能是错误的,但也可能是干扰素需要在感染早期给药,或者需要皮下或静脉注射(Solidarity试验的给药方式)以外的给药方式。
Baillie 还指出,现在正在使用其他遗传关联来确定治疗的优先级。一个例子是广受赞誉的英国 RECOVERY 试验,该试验最著名地展示了一种常见类固醇对严重 COVID-19患者的益处。该试验正在使用遗传数据来帮助选择要测试的药物——包括一种名为 baricitinib 的类风湿性关节炎药物和一种名为富马酸二甲酯的治疗牛皮癣和多发性硬化症的药物。Baillie是该项目的成员之一。
Baricitinib 抑制TYK2 编码的蛋白质,TYK2与重症新冠相关。Baillie 指出,基因研究并未完全明确 TYK2 活性与严重 COVID-19 风险之间的关系,但它确实为这一想法提供了大量额外的支持来源。富马酸二甲酯之所以被包括在RECOVERY试验内,主要是因为它在治疗严重的 COVID-19 炎症过程中的已知作用,但遗传联系为在 RECOVERY 中对其进行测试提供了额外的支持。
然而,GWAS 也以提供令人头疼的结果而闻名。COVID-19 也发生了这种情况:对新冠风险影响最大的突变位于研究不充分的3号染色体上。Butler-Laporte表示,他们仍然不太清楚为什么该突变如此重要。3号染色体区域包括几个与免疫信号、肺生物学和其他可能的机制有关的基因。但尚不清楚这些基因中的哪一个可以解释与 COVID-19 的关联。
携带这种基因变异的人因 COVID-19 住院的可能性大约是其他人的两倍。由 Richards、Ganna 和 McGill 的遗传学家和呼吸内科医生 Tomoko Nakanishi 领导的一项研究发现,该变异引起的60岁或以下人群因 COVID-19 患重病或死亡几率增加的幅度甚至可能超过其在糖尿病、肥胖和慢性阻塞性肺病风险中的贡献。
风险评分
由于这种关联,一些研究人员正在探索 GWAS中出现的遗传联系是否可用于预测个体发生重症新冠的风险。风险评分将 GWAS 中发现的关联合并在一起,已被用于衡量个人患 2 型糖尿病、各种癌症和心血管疾病等疾病的风险。
但鉴于疫苗的可用性,目前尚不清楚这种方法是否适用于 COVID-19——甚至是否需要。 6 月,澳大利亚菲茨罗伊的一家名为 Genetic Technologies 的公司启动了一项 175 美元的测试,以预测人们患上严重 COVID-19 的风险。但它也依赖于年龄、性别和健康,所有这些因素都可以显著提高 GWAS基因关联的预测能力。
首席科学官 Richard Allman 表示,该公司的测试是使用英国生物银行(UK Biobank)数据库中的数据来开发和验证的,可能对中年人最有用。大多数人患严重 COVID-19 的风险相对较小,但该测试可以识别出那些发生危及生命感染的机会大大增加(或大大减少)的罕见个体。该公司的测试目前仅在美国通过新泽西州皮斯卡塔韦一家名为 Infinity BiologiX 的公司进行,并获得了健康专业人士的指导。不过,Allman 表示,Genetic Technologies 仍在与有兴趣向员工提供测试的公司进行谈判,但他没有销售数据。
Nakanishi、Richards和Ganna表示,目前尚不清楚该测试是否经过充分验证以确保可靠,但这并不意味着此类测试不能作为高危人群接种疫苗的另一个动机。遗传技术生物统计学家Gillian Dite补充道:这可能会让一些担心 [接种疫苗] 的人不知所措。
COVID-19的基因研究——与大多数其他疾病的基因研究一样——绝大多数基于具有欧洲血统的人。Knight表示,这是一个问题,因为 COVID-19 的全球负担以及美国和英国等国家少数族裔群体的疾病发病率升高。我们真的需要对这些人群的遗传学进行投资。
多样化的遗传研究不仅可以提高对欧洲人群中发现的风险变异的理解,还可以在其他群体中发现新的变异。一项包括日本2000多名因 COVID-19住院的 GWAS 研究确定了许多欧洲人群研究已经发现的变异,以及一种名DOCK2的免疫基因,该基因与干扰素合成有关,但其他研究未发现该基因与新冠的关联。增加 COVID-19风险的DOCK2变体在东亚人中相对常见,但在欧洲、南亚和非洲血统的人群中却非常罕见。研究负责人、日本大阪大学(Osaka University)的统计遗传学家 Yukinori Okada 表示,这告诉我们增加 COVID-19 宿主遗传多样性的重要性。
罕见的突变
一些研究人员认为,GWAS方法发现的常见变异只会少量增加个体的风险,相比之下,发现导致健康个体重症住院的罕见基因可能更有意义。
这是纽约市洛克菲勒大学(Rockefeller University)遗传学家Jean-Laurent Casanova的观点。他共同领导了一个名为 COVID Human Genetic Effort (新冠病毒人类遗传研究)的项目,该项目在 2020 年 9 月报告发现了严重 COVID-19患者携带的突变,这些突变使1 型干扰素免疫的基因失效。(他们发现突变的基因之一——编码干扰素受体亚基的 IFNAR2,也被多个 GWAS研究标记。)Casanova 团队发现的突变很罕见,但在后续研究中,研究人员发现,10% 的重症新冠患者产生了使 1 型干扰素失活的抗体——其作用与IFNAR2基因突变一样。Casanova指出,他的团队只有在确定基因突变后才寻找它们,这突显了这种方法指向新研究方向的力量。从本质上讲,他们破解的是重症COVID-19肺炎的机制。
康涅狄格州纽黑文市耶鲁大学(Yale University)免疫学家 Akiko Iwasaki指出,具有深远影响的罕见突变是揭示疾病机制的“重要火炬”,他的团队正在研究新冠重症患者体内,攻击人体自身免疫系统的“自身抗体”的作用。据她补充,在 GWAS 中识别出的常见变异的影响可能更微妙,但GWAS识别关联的无偏倚方式意味着其结果能为通过其他方式识别的风险基因增加可信性。它解释了我们看到的一些事情,这是Iwasaki喜欢GWAS的原因。
Richards是一个试图复制Casano的基因发现的团队的一员,但迄今为止没有成功。他和他的同事发现,在近 2000 名 COVID-19 患者中,13 种 1 型干扰素基因的突变并不比未知感染者更常见,这与生物技术公司 Regeneron 研究人员开展的分析结论一致。Regeneron的工作人员研究了超过 50 万名英国生物银行参与者的蛋白质编码基因。Richards表示,这并不意味着1 型干扰素通路不重要,而且他同意自身抗体看起来很有希望。
意大利锡耶纳大学(University of Siena)的遗传学家、HGI 的早期成员 Alessandra Renieri 指出,如果研究人员要充分了解 COVID-19 的易感性,GWAS 的发现需要与稀有变异和其他形式的遗传多样性的联系相结合,并提出治疗方法。她所在的团队已申请意大利监管机构的许可,以测试基于基因发现的疗法。
例如,该团队希望在携带一种使TLR7失活的罕见突变的人群中测试一种佐剂(唤醒免疫系统)。TLR基因参与机体的病毒检测,可能与重症COVID-19相关。该团队还想在携带一种睾酮受体的常见突变(该突变导致血液中循环的睾酮浓度降低)的男性中测试激素睾酮是否能够预防COVID-19致死率,因为该团队发现该突变与重症新冠有关。
研究人员表示,此类试验的成功不应成为判断 COVID-19 基因研究成果的唯一指标。其他生物学家正在利用基因研究来帮助理解他们自己的病毒实验。3号染色体等令人费解的关联有助于制定COVID-19 以及今后新的新型冠状病毒引起的疾病的疗法。
Renieri 指出,每一个新的基因发现就像一块拼图。不同部分正在汇集在一起。他相信在不久的将来,故事会更加完整。
原文检索:
Ewen Callaway. (2021) The quest to find genes that drive severe COVID. Nature, 595: 394-396.
张洁/编译