利用双特异性抗体靶向癌症治疗
双特异性抗体可能为治疗癌症提供现成的免疫疗法。
基于蛋白质的免疫疗法提供了通用的或者说现成的免疫疗法,与高度个性化的工程化的免疫细胞疗法有所不同。例如,T细胞参与的双特异性抗体CD3 BsAb(CD3 bispecific antibodies)可以触发T细胞上CD3表面受体的信号,同时也可以与肿瘤细胞上的第二靶蛋白结合,从而通过一个抗体分子激活细胞毒性T细胞的同时也消灭了癌细胞。但这种方法存在挑战,包括识别共有的癌症选择性靶点和蛋白质工程来重新引导T细胞。Hsiue等人的研究和Douglass等人的研究描述了可以识别突变新抗原(mutation-associated neoantigen, MANA)的CD3 BsAbs的开发。此外,Paul等人描述了一种利用T细胞受体(T cell receptor, TCR)特异性抗体选择性消除T细胞恶性肿瘤的CD3 BsAb。在未来,这些免疫治疗剂可用于治疗具有特定突变的各种癌症。
肿瘤抗原可分为肿瘤相关抗原(tumor-associated antigen, TAA)或肿瘤特异性抗原(tumor-specific antigen, TSA)。TAA是由癌细胞异常表达的,但并不是其特异性表达的。由于正常组织也表达TAA,尽管水平较低,因此,针对TAA的免疫疗法的靶向肿瘤外毒性是一个问题。相反,TSA只在癌细胞上表达。MANA是TSA的一个亚类,其表达来源于癌基因中常见的突变热点。新一代测序与蛋白质组学和生物信息学工具相结合,加速了MANA的发现,特别是重点关注那些来自癌症驱动基因(突变后给细胞带来选择性生长优势的基因)的MANA,如肿瘤抑制基因TP53(该基因编码p53)和RAS家族的癌基因(KRAS、HRAS和NRAS)。
MANA和其他细胞蛋白一样,由蛋白酶体加工处理,产生的肽段由与抗原处理相关的异源二聚体转运体(transporter associated with antigen processing)(TAP1 – TAP2)复合物运送到内质网(endoplasmic reticulum, ER)腔内,然后被ER氨基肽酶(animopeptidases)剪切成8~10个氨基酸的肽段。这些突变的新肽(neopeptides)被装载到经典的人类白细胞抗原(human leukocyte antigen, HLA)I类分子上,这些分子在细胞表面以新抗原(pHLA)的形式表达MANA。
通过使用silico预测软件(silico prediction software),我们可以寻找与HLA分子结合的新肽。Hsiue和Douglass等人提供了一个发现和量化新抗原的路线图。每个小组都使用计算机建模来预测癌症中常见的突变蛋白(p53R175H、KRASG12V、HRASG12V、NRASG12V、NRASQ61L和HRASQ61L)与不同的HLA I类分子的结合。例如:p53R175H与HLA-A2结合、KRASG12V与HLA-A3结合、NRASQ61L与HLA-A1结合。为了证实siilico软件的预测,每个团队都使用基于高灵敏度质谱(mass spectrometry, MS)的方法[MANA-选择性反应监测(MANA-selective reaction monitoring, SRM)]来分析HLA结合肽。Hsiue等人估计,人类多发性骨髓瘤细胞系平均每个细胞只有2.4个拷贝的p53R175H/HLA-A2表达。Douglass等人研究表明,KRASG12V中9个和10个的氨基酸长度的肽段都能被HLA-A3处理和表达。但在人肺乳头状腺癌和胰腺导管腺癌细胞系上,只有10个氨基酸长度肽段的KRASG12V被HLA-A3表达,每个细胞分别有9个或3个拷贝。虽然适应性T细胞疗法已经被用于靶向突变的肿瘤基因和肿瘤抑制基因,但这些研究结果直接证实MANA pHLA在人类癌细胞上存在,只不过数量非常少。
TCR模拟(TCR-mimic, TCRm)抗体是一类生物制品,可以识别细胞内蛋白质来源的pHLA。之前描述了包括TCRm在内的CD3双特异性抗体,并显示其在体外介导人结直肠腺癌细胞的T细胞毒性,并在小鼠中消除了人源转化的B细胞。Hsiue和Douglass等人使用噬菌体展示筛选未加工的人类抗体文库以发现特异于其感兴趣的MANA pHLA的TCRms抗体。然后,这两个小组通过使用单链二抗(single-chain diabody, scDb)的形式制作CD3 BsAbs,scDb包括MANA pHLA特异性的单链TCRm抗体片段(Fv)与融合的scFv CD3抗体。当针对表达MANA pHLA抗原的癌细胞时,CD3 scFv基团与CD3结合并激活多克隆T细胞反应。
与任何免疫疗法都一样,安全性和毒性问题是一个潜在的问题。创建对新肽中突变的残基有亲和力的scDb可以减少交叉反应的可能性,从而降低脱靶毒性的风险。两项研究中对TCRm结合选择性的表征表明,scDb可以特异性地识别突变肽段,而不是其对应的野生型或相关突变肽。Hsiue等人利用X射线晶体学提供了scDb仅与突变的p53R175H/HLA-A2结合的结构基础,更广泛地支持利用结构数据来预测scDb的交叉反应性。
Hsiue和Douglass等人描述了具有高灵敏度的scDb可以在体外激活T细胞,以裂解表达少于10个拷贝的新抗原pHLA的人类骨髓瘤细胞和肺乳头状腺癌细胞。此外,Hsiue等人的研究表明,免疫缺陷的小鼠移植人T细胞,然后用H2-scDb处理后,平均每个细胞表达2.4个拷贝p53R175H/HLA-A2的人多发性骨髓瘤细胞系的生长受到抑制。这些研究为CD3 BsAb提供了在极低密度下通过激活多功能T细胞反应,以对抗肿瘤细胞表达的以前不可用药物干预的细胞内靶点,从而消除癌细胞的第一个证据。
迄今为止,已有100多种不同的CD3 BsAb形式被开发出来用于治疗肿瘤。Hsiue和Douglass等人创建了多种形式的CD3 BsAb,包括使用不同的CD3抗体,以确定scDb为最佳形式。可能是由于scDb结构小、紧凑和刚性的特质,是观察到其抗肿瘤活性比其它双特异性抗体形式强的原因。这特别是当涉及到低水平表达的肿瘤靶点时,如Hsiue和Douglass等人所描述的那样,也许scDb更有效的抗肿瘤活性的报道与建立肿瘤细胞和T细胞之间优化的免疫学突触有关。或者,CD3抗体的亲和力或其结合表位也很重要。无论如何,这些发现将可能促进靶向癌细胞上MANA pHLA和其它TAA和TSA的scDb CD3 BsAb的快速发展。
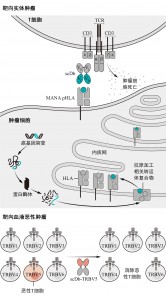
Paul等人描述了一种通过使用scDb分子来消耗T细胞恶性肿瘤(T细胞白血病和淋巴瘤),同时保护健康T细胞的方法。为了建立概念的证明,作者利用了之前确定的TCR β链可变区域的抗体,TRBV5-5和TRBV12(30个可能的TRBV家族成员中的两个),它们形成了T细胞表达的功能性αβ TCR(图:用于癌症免疫治疗的单链双抗体)。由于T细胞恶性肿瘤是克隆性的,并且在其表面上只表达一个TRBV家族成员,因此靶向一个单一的TRBV类型代表了一个理想的TAA,用于选择性地使用CD3 BsAb进行治疗。Paul等人研究表明,由TRBV5-5或TRBV12抗体组成的scDb并与CD3抗体拴系,可以在小鼠模型中选择性地消除表达TRBV5-5或TRBV12的恶性人T细胞,同时保留了大多数不表达靶向TRBV的健康人T细胞。
用于癌症免疫治疗的单链双抗体
在不同实体瘤中,肿瘤抑制基因和癌基因中共有的突变会导致突变相关的新抗原(mutation-associated neoantigens, MANA)的产生,这种新抗原由癌细胞上的人类白细胞抗原(human leukocyte antigens, MANA pHLA)表达。这些可以被CD3双特异性抗体(例如单链双抗体scDb)靶向识别,该抗体可将T细胞重定位靶向肿瘤细胞。表达肿瘤相关抗原(例如T细胞受体TCR β链可变区5, T cell receptor β-chain variable region 5, TRBV5)的克隆性恶性T细胞也可以被scDbs选择性靶向。
虽然Hsuie、Douglass和Paul等人的研究对推进scDb进入临床很有希望,但在完全实现治疗效果之前,还有其它因素需要考虑。scDb是小分子,在人类和小鼠中迅速的从血液中清除,这将可能使其有必要通过植入泵持续输注scDb药物。将免疫球蛋白G(immunoglobulin G, IgG)可结晶片段(fragment crystallizable, Fc)区域添加到scDb分子中,预计将增加其血浆半衰期。然而,Fc域的加入也会产生一个体积较大的分子,可能会在立体上阻碍表位结合,导致抗肿瘤效力降低。尽管进一步鉴定通常共有的MANA pHLA将扩大CD3 BsAb在实体瘤上的可用靶点,但经典HLA I类的多态性限制了可以用这些药物进行靶向的个体数量。为了扩大人群覆盖面,一个替代方案可能是寻找非经典HLA(即HLA-E和HLA-G)所提呈的MANA来源肽段。与经典HLA不同,HLA-E和HLA-G基本上是单态的,它们的活性在癌细胞中是上调的。HLA-E和HLA-G是否提呈来自MANA的肽,可能值得去研究。
有一些与肿瘤微环境相关的潜在问题可能会限制CD3 BsAb的有效性,包括scDb对血液学恶性肿瘤和实体瘤的效果。例如,在已经观察到有限的T细胞活化的情况下,正在寻求与激动性抗体组合以活化共刺激受体如CD137。血液病和实体瘤都是通过抑制免疫检查点的表达来主动逃避免疫细胞的反应,这将对CD3 BsAb介导的T细胞激活产生负性影响。可能的解决方案包括与免疫检查点阻滞剂联合使用,例如可阻断细胞毒性T淋巴细胞相关蛋白4(cytotoxic T lymphocyte–associated protein 4, CTLA-4)和程序性细胞死亡蛋白1(programmed cell death protein 1, PD-1)的抗体,从而激活T细胞。此外,一些实体瘤缺乏T细胞浸润,正在评估BsAb与溶瘤病毒和癌症疫苗的组合,以促进T细胞向肿瘤的运输。Hsiue、Douglass和Paul等人的研究,提供了一种潜在的途径,可以实现基于蛋白质的即成的免疫疗法,用于治疗具有特定TAA或表达例如MANA突变的癌症。但是,要实现这一宏伟目标,还需要做更多的工作。
原文检索:
Jon Weidanz. (2021) Targeting cancer with bispecific antibodies. Science, 371(6533): 996-997.
郭庭玥/编译