新冠病毒在突变!这意味着什么?
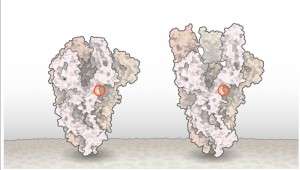
SARS-CoV-2的刺突蛋白似乎发生了一种常见突变(圆圈处),该突变使刺突蛋白从闭合状态(左)变为开放(右)状态。
各种SARS-CoV-2毒株尚未对大流行过程产生重大影响,但将来可能会有重大影响。
今年,COVID-19在全球范围内肆虐。David Montefiori想知道大流行背后的致命病毒在人与人之间传播时可能发生的变化。Montefiori是一位病毒学家,他在职业生涯中的大部分时间都在研究艾滋病毒的偶然突变如何帮助其逃避免疫系统的攻击。他认为,SARS-CoV-2可能会发生同样的突变。
3月,负责北卡罗来纳州达勒姆杜克大学(Duke University)艾滋病疫苗研究实验室的Montefiori与他的长期合作者、艾滋病毒进化专家Bette Korber再度携手。新墨西哥州洛斯阿拉莫斯国家实验室(Los Alamos National Laboratory, LANL)的计算生物学家Korber已经开始分析数千种SARS-CoV-2的基因序列,寻找可能会改变其病毒特性的突变。
与HIV相比,SARS-CoV-2的传播速度要慢得多。但是Korber发现了一个引人注目的突变。它位于编码刺突蛋白的基因中,该蛋白有助于病毒颗粒穿透细胞。Korber看到该突变一次又一次出现在COVID-19患者的样本中。在刺突蛋白的第614个氨基酸位置,由于复制错误导致天冬氨酸(简写为D)被甘氨酸(G)取代。 病毒学家将这一突变称为D614G突变。
4月,Korber和Montefiori等人在发布到bioRxiv服务器的预印本中提醒,D614G突变的频率正在以惊人的速度增加。它已迅速成为欧洲主要的SARS-CoV-2病毒株,然后在美国、加拿大和澳大利亚也大规模出现。该论文宣称,D614G代表“SARS-CoV-2的更易传播形式”,它是自然选择的产物。
这些主张使许多科学家感到沮丧。他们指出,目前还不清楚D614G病毒谱系是否可以传播,或者它的激增表明有什么不寻常的现象。但是警报迅速在媒体上传播开来。尽管许多新闻报道都包括研究人员的警告,但一些头条新闻却宣称该病毒正在变异,变得更加危险。事后回顾,Montefiori表示,他们后悔将这个变种的激增描述为“警报”。Montefiori在7月2日投给《细胞》(Cell)杂志的同行评审版本中删除掉了“警报”一词。
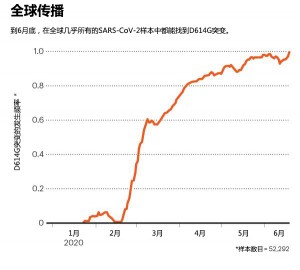
这项工作激发了人们对D614G的兴趣。甚至那些质疑这种突变改变了病毒特性的人也不得不承认,D614G非常引人注目,因为其数目激增,且无处不在。几个月以来,几乎在所有SARS-CoV-2测序样本中都发现了该突变(图:全球传播)。对于Korber和Montefiori投稿给投给《细胞》(Cell)杂志的那篇论文,康涅狄格州纽黑文市耶鲁大学公共卫生学院(Yale School of Public Health)的病毒流行病学家Nathan Grubaugh等人这样写道,现在,这种变种非常普遍。因此,研究它的作用很重要。
到目前为止,这项工作的结果还没有Montefiori和Korber的预印本所暗示的那样清晰。一些实验表明携带该突变的病毒更容易感染细胞。其他工作却揭示了可能的好消息:这种变异可能意味着疫苗可以更轻松地靶向SARS-CoV-2。但是许多科学家指出,尚无确凿证据表明D614G对病毒的传播有重大影响,或者自然选择的过程可以解释其水平的上升。北卡罗来纳大学教堂山分校(University of North Carolina at Chapel Hill)的冠状病毒学家Timothy Sheahan指出,现在众说纷纭,事实上这种突变可能意味深远,也可能没有什么意义。
Sheahan和Grubaugh等人表示,研究人员对冠状病毒突变的疑问仍然比答案多,而且尚未发现值得引发公众担忧的突变。但是,详细研究突变可能对控制大流行很重要。它还可能有助于避免最令人担忧的突变:那些可以帮助病毒逃避免疫系统、疫苗或抗体疗法的突变。
缓慢变化
在中国发现SARS-CoV-2后不久,研究人员开始分析病毒样本并在线发布遗传密码。突变——大多数是来自不同人的病毒之间的单碱基变异——使研究人员可以通过联系紧密相关的病毒来跟踪传播,并估计SARS-CoV-2何时开始感染人类。
SARS-CoV-2、HIV和流行性感冒等RNA病毒在复制到宿主内部后,往往会迅速产生突变,因为复制RNA的酶容易出错。例如,严重的急性呼吸道综合症(severe acute respiratory syndrome, SARS)病毒在人体内开始传播后,就发展出一种缺失的突变,这种突变可能会减慢其传播速度。
但是测序数据表明,冠状病毒的变化要比大多数其他RNA病毒慢得多,这可能是由于“校对”酶可以纠正潜在的致命复制错误。巴塞尔大学(University of Basel)分子流行病学家Emma Hodcroft指出,典型的SARS-CoV-2病毒每月在其基因组中仅积累两个单碱基突变——突变率约为流感病毒的一半,为HIV的四分之一。
科学家已对90000多株分离株进行了测序并公开(请参见www.gisaid.org)。这些基因组数据也强调了这种基因稳定性。伦敦大学学院(University College London)的计算遗传学家Lucy Van Dorp指出,从世界各地收集的任意两种SARS-CoV-2病毒之间,在总长29903个碱基中,平均仅存在10个碱基的差异,这是一种进化优势。
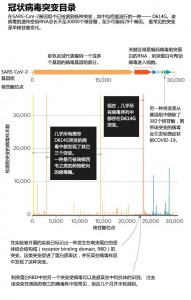
尽管该病毒的突变率很低,但研究人员已经在SARS-CoV-2基因组中分类了超过12000个突变。但是科学家理解突变的速率比不上发现它们的速度。许多突变不会影响病毒传播或引起疾病的能力,因为它们不会改变蛋白质的形状,而那些确实改变蛋白质的突变更可能损害病毒而不是改善病毒(图:冠状病毒突变目录)。Nextstrain(实时分析SARS-CoV-2的团体)的成员Hodcroft表示,毕竟破坏一个东西比修复它要容易得多。
许多研究人员怀疑,如果某种突变确实有助于病毒更快地传播,那么它可能会更早发生,可能发生在该病毒首次跨种族传播给人类或获得了有效人际传播能力的时候。现在全球每个人都能被轻易感染,病毒几乎没有进化上的压力来实现更好的传播,因此即使潜在的有益突变也可能不会繁荣发展。哈佛大学陈曾熙公共卫生学院(Harvard T. H. Chan School of Public Health)的流行病学家William Hanage指出,该病毒可以轻易地感染每个个体,没有自然选择的压力让它具有更好的感染力。
传播速度更快?
当Korber看到D614G的迅速普及时,她认为自己可能已经找到了有意义的自然选择的例子。这种突变因其在刺突蛋白中的位置而引起了她的注意。该位点是中和抗体实现结合、消除病毒感染力的主要靶标。而且具有这种突变的病毒在多个地区的数目激增。
最早在一月下旬,科学家在中国和德国收集的病毒中发现了D614G突变。大多数科学家怀疑这种突变是在中国出现的。现在D614G几乎总是伴随着另外三个突变,这可能是大多数D614G病毒具有共同祖先的证据。
D614G在欧洲的迅速增加引起了Korber的注意。3月之前(当时欧洲大部分地区都处于封锁状态),既存在未突变的“D”病毒,又存在突变的“G”病毒,而D病毒在当时遗传学家采样的大多数西欧国家中都很普遍。据Korber和Montefiori等人报道,3月开始G病毒在整个欧洲大陆的频率上升,到4月占主导地位。
但是,自然选择支持G病毒并不是这种激增的唯一解释,甚至不是最可能的解释。G突变在欧洲的统治地位可能只是偶然,例如,如果这种突变恰好在抵达欧洲的病毒中更常见。少数人是该病毒大规模传播的起源,而早期患者以G病毒居多的偶然倾向可以解释该谱系现在的主导地位。这种“奠基者效应”在病毒中很常见,尤其是当它们不受控制地传播时,就像SARS-CoV-2在3月中第3月底,在欧洲大部分地区肆虐。
Korber等人试图通过在4月的预印本中证明D614G在加拿大、澳大利亚和美国部分地区迅速占主导地位来排除奠基者效应的影响(冰岛除外,冰岛疫情暴发初期已存在G病毒,随后被D病毒所取代)。通过分析英国谢菲尔德的住院数据,研究小组没有发现携带这种突变的病毒使人患病的证据。但是,那些感染了G病毒的人的鼻子和嘴里的病毒RNA水平似乎要高于那些感染D病毒的人。
许多科学家不相信D614G的崛起有多重要——或对大流行有多大意义。Sheahan认为Korber在预印本里提出的结论还为时过早。
Montefiori表示,他和Korber对D614G的看法是由他们对HIV的研究所形成的。该研究发现,即使看似微不足道的突变也可以对免疫系统如何识别该病毒产生深远影响。他们对此感到震惊,需要看看它是否对疫苗有影响。
实验室研究热潮
为了进一步检查D614G是否使该病毒更易于传播,Montefiori在实验室条件下评估了其作用。由于需要生物安全措施,他无法在实验室研究天然SARS-CoV-2病毒。因此,他研究了一种利用SARS-CoV-2刺突蛋白感染细胞的艾滋病毒的基因改造形式。这样的“伪病毒”颗粒是病毒学实验室的主力军:它们使安全研究致命病原体(如埃博拉病毒)成为可能,并且使测试突变的作用变得更容易。
6月,由加亚州拉霍亚斯克里普斯研究所(Scripps Research Institute)的病毒学家Hyeryun Choe和Michael Farzan领导的小组首次报告了在D614G上进行假病毒实验的结果。其他几个小组也在bioRxiv上发表了类似的研究(Montefiori和另一位合作者的实验已发表在Cell论文中)。各个研究小组使用了不同的伪病毒系统,并在各种类型的细胞上对其进行了测试,但是实验得出的结论是相同的:携带G突变的病毒比D病毒感染细胞的能力要好得多,在某些情况下,效率要高十倍。
麻省大学医学院(University of Massachusetts Medical School)的病毒学家Jeremy Luban提醒,在实验室测试中,我们所有人都同意,从D突变成G,会使病毒更具感染性。但是需要注意的是——它们与人类感染的相关性尚不清楚。Grubaugh表示,令人恼火的是,一些人基于在受控环境中得到的结果,就草率下结论,说这对疫情有很大影响。事实上,我们距离了解真相还非常遥远。在大多数情况下,假病毒仅携带冠状病毒刺突蛋白,因此实验仅测量这些颗粒进入细胞的能力,而不测量其在细胞内部的作用,更不用说对生物体的作用了。并且这些假病毒还缺少几乎所有D614G病毒都携带的其它三个突变。Luban指出,最重要的是,它们不是SARS-CoV-2病毒。
现在,有些实验室正在研究传染性SARS-CoV-2病毒,它们之间的区别仅在于单个氨基酸。科学家利用这些病毒在人肺和气道细胞的实验室培养物中以及在诸如雪貂和仓鼠的实验动物中进行了测试。Sheahan指出,对于拥有丰富经验和具有操作病毒的生物安全能力的实验室而言,这就像是一种生硬的工作。9月2日的预印本报道了其中的第一项研究,该研究来自加尔维斯顿的德克萨斯大学医学分校(University of Texas Medical Branch)的研究人员。该研究发现,在人类肺细胞系和气道组织中,携带突变的病毒比D病毒更具感染力,并且在被感染的仓鼠上呼吸道中,突变病毒的含量更高。
即使这些实验也可能无法下定论。爱荷华大学(University of Iowa)的冠状病毒学家Stanley Perlman指出,一些研究表明,中东呼吸综合征(Middle East respiratory syndrome, MERS)病毒中刺突蛋白的某些突变会导致小鼠患上更严重的疾病——但该蛋白中的其它突变对人或骆驼的影响很小,骆驼可能是把MERS传播给人的来源。
D614G对SARS-CoV-2在人类中传播的影响最明显的迹象来自英国的一项雄心勃勃的努力,即COVID-19 Genomics UK Consortium。该联盟分析了大约25000个病毒样品的基因组。从这些数据中,研究人员已经确定了1300多种病毒进入英国并传播的实例,包括D型和G型病毒。
由英国爱丁堡大学(University of Edinburgh)的进化生物学家Andrew Rambaut、伦敦帝国理工学院(Imperial College London)的流行病学家Erik Volz和加的夫大学(Cardiff University)的生物学家Thomas Connor领导的团队研究了62个由D病毒和245个由G病毒引发的感染人群。研究人员发现,感染这两种病毒的人没有临床差异。但是,G病毒的传播速度比没有突变的病毒株要快一些,并形成了更大的感染群。Volz指出,他们对传输速率差异的估计在20%左右,但真实值可能会更高或更低。Rambaut表示,从绝对意义上讲,影响不大。
Rambaut指出,D614G可能是一种改造品,可以帮助病毒感染细胞或与不携带这种变化的病毒竞争,而SARS-CoV-2在人与人之间或在人群中的传播方式几乎没有改变。Grubaugh表示同意,认为这可能是病毒对人类或某些人类细胞的真正适应,但这并不意味着任何实际性的改变。突变不必使其更具传播性。”
Grubaugh认为D614G受到了科学家的过多关注,部分原因是发表了一些高调的D614G相关论文。科学家对这些突变非常着迷。但他也将D614G视为了解一种遗传多样性相对少的病毒的一种方法。他觉得作为一个病毒学家,看着这些东西,觉得了解它会很有趣。以突变为切入点,说不定能看到整个故事。
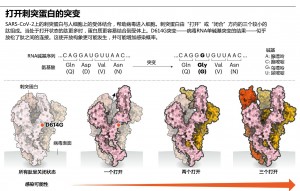
无独有偶。Luban指出,对D614G的深入研究应有助于解释SARS-CoV-2如何与细胞融合,这一过程可能被药物阻断或被疫苗靶向。在7月16日发布在bioRxiv上的伪病毒实验的更新版本中,Luban的团队使用了冷冻电子显微镜来分析带有D614G变化的刺突蛋白的结构。刺突蛋白由“打开”或“闭合”方向的三个相同的肽组成。先前的研究表明,三种肽中至少有两种需要打开才能使病毒颗粒与细胞膜融合,Luban的研究小组发现携带G变体的病毒更可能处于这种状态(图:打开刺突蛋白的突变)。由Korber的LANL同事Sandrasegaram Gnanakaran领导的Montefiori和Korber的计算建模工作得出了相同的结论。Luban指出:“看来这台分子机器运转的方式与D病毒不同。
无法逃脱抗体追捕
正如Montefiori担心的那样,大多数现有证据表明D614G不会阻止免疫系统中和抗体识别SARS-CoV-2。这可能是因为突变不在棘突蛋白的受体结合域(RBD)中。RBD是许多中和抗体靶向的区域:RBD与细胞受体蛋白ACE2结合,这是病毒进入细胞的关键步骤。
但是,有证据表明其它突变可以帮助病毒抵抗某些抗体。纽约洛克菲勒大学(Rockefeller University)的病毒学家Theodora Hatziioannou和Paul Bieniasz领导的研究小组对水疱性口炎病毒(一种牲畜病原体)进行了基因改造,使其利用SARS-CoV-2刺突蛋白感染细胞,并使其在中和抗体的存在的情况下生长。他们的目标是选择使刺突蛋白产生逃避抗体识别的突变。实验产生了刺突蛋白突变体,该突变体对从COVID-19中恢复的人的血液中采集的抗体具有抗性,并且对正在发展为疗法的有效“单克隆”抗体具有抗性。 Hatziioannou和Bieniasz等人的团队报告表示,每种能抵抗中和抗体的突变都能在来自病人的病毒株中找到,尽管频率极低(这表明阳性选择并未使突变更加普遍)。
其他科学家通过预测哪些突变可能很重要,来了解SARS-CoV-2可能的进化路径。华盛顿西雅图弗雷德·哈金森癌症研究中心(Fred Hutchinson Cancer Research Center)的进化病毒学家Jesse Bloom带领的一个团队创建了近4000个突变型刺突蛋白RBD的突变版本,并研究了这些变化如何影响刺突蛋白的表达及其与ACE2的结合能力。大多数突变对这些特性没有影响或没有阻碍,尽管有少量改进。其中一些突变已在COVID-19人群中发现,但Bloom的团队没有发现任何自然选择的迹象。他指出,病毒与ACE2的结合已经足够好了。
Bloom并未测试是否有任何突变能使病毒阻止抗体的作用,但他的研究小组的结果表明这种改变是可能的。Bloom认为,这种病毒可能会(但不完全确定)发生突变,从而改变其对抗体和免疫力的敏感性。
根据其它冠状病毒的经验,病毒形成免疫抵抗可能需要数年。跨季节采样的流感病毒研究已经确定了其对免疫反应的进化迹象。但伯尔尼病毒和免疫学研究所(Institute of Virology and Immunology)的RNA病毒学家Volker Thiel指出,突变的速度很慢。这些病毒株或多或少保持不变。
由于世界上大多数地区仍然容易感染SARS-CoV-2,因此免疫力目前不太可能成为病毒进化的主要因素。Sheahan指出,但是随着整个人群免疫力的提高,无论是通过感染还是通过疫苗接种,不断逃避免疫突变的亚病毒株都可以帮助SARS-CoV-2永久性在人群中存在,当它感染之前感染过或接种过疫苗的个体时,可能会引发非常轻微的症状。如果这种病毒进化成更常见、症状更轻的类流感病毒,Sheahan不会感到惊讶。但是,我们对冠状病毒感染(包括对SARS-CoV-2)的免疫反应也可能不够强大,或寿命太短,不足以产生选择压力,从而不会让病毒株产生明显改变。
如果不明智地使用抗体疗法,令人担忧的突变也可能会变得更加普遍——例如,如果COVID-19的患者接受一种抗体,那么病毒可能会因为筛选压力而发生抵抗该抗体的突变。研究人员表示,单克隆抗体鸡尾酒疗法,每个单抗都可以识别刺突蛋白的多个区域,可能会减少这种突变通过自然选择而受到青睐的可能性。疫苗在这方面的担忧较少,因为与人体的自然免疫反应一样,疫苗往往会引发一系列抗体。
Montefiori的小组在7月13日发布给bioRxiv的一项研究中发现,D614G突变甚至可能使该病毒更容易成为疫苗的靶标。小鼠、猴子和人类接受了多种实验性RNA疫苗中的一种,其中包括由纽约制药商辉瑞公司(Pfizer)开发的一种。结果显示,相比于D病毒,疫苗引发的抗体在阻断G病毒上更有效。
Montefiori指出,现在G病毒无处不在,这一发现是“好消息”。但是,作为一名观察艾滋病毒突变对抗疫苗的科学家,他仍然对SARS-CoV-2逃避人类反应的潜力保持警惕。Luban同意这一观点,认为我们需要警惕其他变化。
原文检索:
Ewen Callaway. (2020) The coronavirus is mutating — does it matter? Nature, 585: 174-177.
张洁/编译