基因治疗面临巨大挑战
多年来,Grajevis Bakatunkanda的镰状细胞贫血症一直没有得到诊断。
基因治疗作为潜在的治疗遗传疾病的手段,现在正面临治疗镰状细胞病的挑战。
Grajevis Bakatunkanda的母亲深知,当她的儿子对晚餐失去兴趣时,就意味着痛苦即将来临。这种情况几乎每周都会像时钟一样准确无误地报时。然后,这个害羞、瘦弱的刚果男孩就住进了他们家附近的医院,那里的医生会给他注射吗啡止痛,还总是诊断他得了疟疾。
结果证明医生错了。罪魁祸首不是寄生虫,而是Bakatunkanda自己的红细胞。正常情况下,人的红细胞是柔软有弹性的,但在Bakatunkanda体内有些细胞却发生了变形和僵硬,如木头碎片一样。它们会滞留在他的毛细血管中,阻碍血液流向重要器官,并将一波又一波的剧痛送入他的背部和胸部。
直到2003年这家人移民到南非的开普敦,他们才知道Bakatunkanda患上的是镰状细胞贫血症(sickle-cell anaemia),这是世界上最普遍的遗传病之一,也是一个多世纪以来一直被研究的疾病。但这个诊断并没有缓解男孩的痛苦:医生给他开的鸡尾酒药(每种药物都有半个多世纪的历史)里并没有一种专门针对镰状细胞病的成分,也即并没有打破他的疼痛—缓解的循环魔咒。
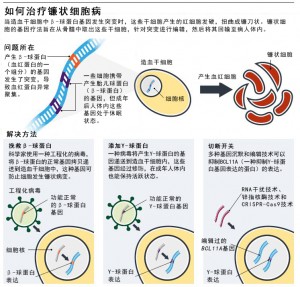
Bakatunkanda现在已经22岁了,现代的解决方案即将以基因疗法的形式出现。经过几十年的工作和一些痛苦的挫折,涉及改变一个人的基因组的技术已经开始被批准用于治疗少数罕见疾病。科学家现在正努力将最新的进展——包括一些使用更新的基因编辑技术——扩展到镰状细胞病,这种疾病影响着全世界约2000万人(图“如何治疗镰状细胞病”)。目前有6个以上的临床试验正在进行中,更多的试验正在计划中。位于佐治亚州亚特兰大市的埃默里大学(Emory University)的儿科血液学家Lakshmanan Krishnamurti指出,这些研究就快有结果了,这是一个激动人心的时刻。
但是对于基因治疗领域来说,镰状细胞病在伦理和技术上都是巨大的挑战。已经被批准用于其它疾病的基因疗法的价格超过了100万美元。但是镰状细胞病集中在世界上的一些地区,如撒哈拉以南的非洲、印度和加勒比地区,那里很少有人有资源来支付如此昂贵的费用。镰状细胞的实验治疗也很复杂,需要长期住院和大型学术医疗中心的专业知识。即使对那些能够获得这些资源的人来说,这些冒险也不一定是值得的。
随着早期试验数据的流入,科学家正在努力改进他们的方法,而资助者已经开始着手解决公平问题。10月23日,NIH和比尔及梅琳达·盖茨基金会(Bill & Melinda Gates Foundation)宣布,他们将在未来4年内投资至少2亿美元,将基于基因的镰状细胞病和艾滋病治疗引入资源匮乏的地区。
Bakatunkanda为镰状细胞病患者建立了一个支持小组,他相信,如果基因疗法被证明是有效的,那么总有一天会推广到他的国家,尽管它的成本很高,而且极其复杂。
他和其他人必须严格控制自己的期望。印度那格浦尔政府医学院(Government Medical College)的儿科医生Dipty Jain表示,他的病人会上网。病人来找Jain,问可以去做基因治疗吗?Jain只能告诉他们,现在还不是时候。
Bakatunkanda用一种年代久远的药物来对抗他的疾病。虽然基因疗法听起来很有吸引力,但他知道存在一定的风险。
一个医学革命
1910年,来自西印度群岛格林纳达的一名年轻牙医学生Walter Clement Noel首次发现了镰状细胞病典型的细长、形状怪异的血细胞。40年后,当生物化学家Linus Pauling等人报告说,镰状细胞病患者体内的血红蛋白结构的变化导致了红细胞的形状时,这种疾病的发病机理才开始显现出来。
这一发现标志着遗传疾病的影响首次被追溯到其分子根源。Pauling把这种情况称为“分子疾病”。几年后,研究人员发现β-globin蛋白质的变化是红细胞形态扭曲的原因。该蛋白基因的两个拷贝的突变导致疾病:该基因的单拷贝突变不太会引起症状,反而会保护携带者免受血液寄生虫,如引起疟疾的寄生虫的寄生。也即在疟疾流行的地方,镰状细胞突变为人类提供了保护,因此变得普遍。这在一定程度上解释了为什么在疟疾流行的地方,这种疾病的发病率相对较高。开普敦大学(University of Cape Town)的遗传学家Ambroise Wonkam指出,这是人们现在所知道的所有人类医学遗传学发展的基础。
位于拉各斯的尼日利亚镰状细胞基金会(Sickle Cell Foundation Nigeria)的创始人和首任主席、血液学家Olu Akinyanju指出,在Pauling发现镰状细胞病的70年后,许多非洲国家的镰状细胞病仍未得到充分诊断。然而,早期诊断可以挽救生命。每年有超过30万人出生时就患有这种疾病,如果没有预防性抗生素和疫苗来帮助预防其它感染,大多数人将在5岁之前死亡。那些存活下来的人将终生疼痛危,并面临中风和感染的风险。
镰状细胞病多发于低收入国家,这意味着它在历史上很少受到富裕地区制药公司和政府的关注。Akinyanju表示,鉴于许多非洲国家有非常多紧迫的公共卫生需求,因此很难将镰状细胞病推到它们的优先事项列表的首位。他数十年来一直在努力促使非洲各国政府制定治疗计划。
然而,在过去的十年里,Akinyanju和其他人已经注意到了这种转变。随着倡导者和临床医生推动新生儿筛查和早期干预,镰状细胞病患者的平均寿命显著延长。这种情况已经不像以前那样受到指责了。Akinyanju自豪地列举了一些患有镰状细胞病的朋友,他们活到了60多岁甚至更老,成为了医生、法官和世界旅行者。
WHO和美国血液病学会(American Society of Haematology)也努力让研究人员和制药公司注意到这种疾病。Wonkam指出,Bakatunkanda和其他移民提高了富裕国家的意识。有迹象表明,这种关注正在得到回报。11月25日,FDA批准了一种镰状细胞药物,旨在减少血红蛋白分子之间的结块。
但是,尽管基因疗法对镰状细胞病——世界上最著名的遗传疾病之一——来说似乎是一种合理的方法,该领域也面临着挫折。1999年,高调去世,这给早期的尝试蒙上了阴影。当时,他正在参加首批基因治疗临床试验之一。该临床试验中用于替换血液干细胞中免疫系统基因的一种程序导致了几名参与者发生了白血病。
马萨诸塞州波士顿儿童医院(Boston Children’s Hospital)的血液学家 David Williams表示,在这种背景下,一些人认为现在就对镰状细胞病应用基因疗法还为时过早。镰状细胞病不是一种立即致命的疾病,在某些方面,用高风险的实验方法来治疗这些病人是不道德的。
此外,加州大学洛杉矶分校(University of California, Los Angeles)儿科骨髓移植专家Donald Kohn表示,目前的基因编辑工具还不足以完成这项任务。如果研究人员要将正常的血红蛋白基因移植进去,就需要能够产生大量的蛋白质,以充分减弱镰状体的影响。Kohn提醒,早期的基因治疗技术不能在人类细胞中以如此高的水平表达基因。
但尽管有这些挫折,一些基因治疗研究人员仍在继续努力,希望开发出更安全、更有效的方法来将基因植入细胞。他们在2016年取得了突破,当时欧盟委员会(European Commission)批准了一种基因疗法,用于治疗ADA-SCID(ADA型重症联合免疫缺陷,一种由腺苷脱氨酶ADA缺陷所致的免疫缺陷疾病)。然后在2017年,FDA批准了一种基因疗法来治疗一种罕见的失明。
此时,一些研究人员已经把他们的注意力转回到镰状细胞病上,他们有了更先进的基因编辑工具,并得到了生物技术产业的支持。目前的试验采用了多种方法。Kohn正试图往造血干细胞中插入β-globin基因的一个拷贝,该基因拷贝经编辑后能抵抗细胞发生镰状病变。马萨诸塞州剑桥市的Bluebird Bio公司也基于这种机制开发了一种镰状细胞病基因疗法。纽约市一家金融服务公司Cowen的生物技术分析师Yaron Werber指出,Bluebird Bio公司看来将成为第一家获准在美国推广这种疗法的公司。
另一些人正试图引入编码胎儿血红蛋白的基因的改良拷贝。胎儿血红蛋白是发育中的胎儿产生的一种血红蛋白,但通常在出生后不久就会停止表达。胎儿血红蛋白是一种很有吸引力的选择,因为它和成人血红蛋白一样有效,并且可以防止有缺陷的血红蛋白聚集在一起。
第三种方法是靶向一种阻断机制,这种机制会在胎儿出生后阻断胎儿血红蛋白的产生。通常的关闭开关是一种叫做BCL11A的蛋白质。科学家通过抑制镰状细胞病小鼠体内的BCL11A表达,成功使小鼠体内胎儿血红蛋白的水平一直保持在高水平,从而预防镰状细胞病的症状。在波士顿,Williams已经授权Bluebird Bio公司使用一种名为RNA干扰的技术来降低编码BCL11A的基因在血液干细胞中的表达。加州里士满的Sangamo Therapeutics公司正在与Sanofi公司合作,使用一种名为锌指核酸酶的基因编辑工具来制造使基因失效的突变。波士顿的Vertex制药公司与马萨诸塞州剑桥的CRISPR Therapeutics公司合作,利用CRISPR – Cas9基因编辑技术做了同样的事情。在所有这三种方法中,都涉及将造血干细胞从体内取出,然后在病毒的帮助下进行基因改造,然后重新导入骨髓。在细胞被替换之前,参与者通常会接受一种名为白消安(busulfan)的化疗,以破坏体内剩余的病变干细胞,并帮助回输的基因改造细胞在体内存活下来。
不过,这种疗法是有风险的:参与者可能会患上急性和严重的贫血症。这种疗法会清除他们的白细胞,对肠道内壁造成严重破坏,可能会让他们依赖静脉营养。许多人需要住院一个多月。化疗还会导致不孕,并可能在以后的生活中导致癌症。
这意味着基因治疗可能只会用于那些最严重的镰状细胞病。然而,其中许多人还会有心脏、肾脏或肝脏损伤,这将使化疗过于危险。
镰状细胞病在其他方面也使治疗复杂化。在许多情况下,当医生采集骨髓时,患者首先需要服用一种促进血液干细胞的采集的药物。但是这种方法对于镰状细胞病患者来说太危险了,因为它增加了疼痛的风险。同时,因为患病的红细胞比健康的细胞死亡得快,所以患有镰状细胞病的人的干细胞必须更努力地工作才能产生新的血细胞。这可能使它们在实验室环境一般的培养条件下难以生长。因此,参与者通常需要在取出造血干细胞之前,通过输血来缓解干细胞的压力。尽管有这些挑战,成功的早期迹象已经成为头条新闻。Williams的RNA干扰试验中的一名男子已经一年没有出现任何症状。CRISPR试验的第一个病人在完成了折磨人的治疗后已经出院。11月19日,Vertex和CRISPR Therapeutics公司宣布,患者没有经历任何疼痛,胎儿血红蛋白的水平已经维持了四个月。这两个案例都在社交媒体上引起了轰动——并且在某些情况下,关注太高了。伊利诺伊州芝加哥西北大学(Northwestern University)的血液学家Alexis Thompson表示,人们对病人出院感到兴奋,好像这就等于治愈了疾病。其实并不是,这个标准太低了。更需要关注的是长期的效果。
不过,我们有理由保持乐观。到目前为止,这些试验都没有因为安全问题而停止。蓝鸟Bluebird Bio公司今年6月报告称,该公司已经治疗了13人,其中一些人在接受治疗一年后接受了监测,没有出现严重的疼痛危机。今年6月,欧盟批准该疗法用于治疗地中海贫血病。
但对许多人来说,一个主要的问题是成本。治疗地中海贫血症的费用约180万美元,还不包括住院和其他相关费用。
马萨诸塞州波士顿投资银行SVB Leerink的分析师Mani Foroohar表示,从一生的维度来看,这种疗法仍可能比标准疗法便宜。此外,Bluebird Bio公司建立了一种不同寻常的费用结构:支付期限为五年,如果治疗无效,可以停止支付。Foroohar表示,同样的模式在其他地区是否可行还不清楚。
Jain的很多病人住在印度中部,他们来Jain的医院看病,因为他们负担不起每月约3美元的标准治疗费用。即使在美国,获得基因疗法也可能是个挑战。这一点在美国黑人身上表现得尤为明显,他们获得医疗保健的机会往往比美国白人有限。尽管试验仍处于早期阶段,Krishnamurti敦促有兴趣的人立即开始倡导获得治疗。他认为这是一个巨大的道德问题,Krishnamurti每周都在亚特兰大的医院为镰状细胞病患者提供咨询,在他的社区谈话中,Krishnamurti指出,你最好能参与相关的倡导活动,否则这些决定将在没有你参与的情况下做出。
在俄亥俄州辛辛那提儿童医院(Cincinnati Children’s Hospital),血液学家Punam Malik希望迈出第一步,让基因治疗更便宜、更简单。Malik在印度接受过医生培训,在那里她看到很多人都患有镰状细胞病和相关疾病。大约30年前,当她移民到美国时,她发誓要确保她的研究将造福于资源贫乏国家的人民。
现在,Malik正在领导一项试验,引进能产生胎儿血红蛋白的干细胞。它使用低剂量的一种名为melphalan的药物来移除骨髓中的病变细胞,这应该会比通常用的白消安毒性更小。她希望这项技术能减少长期住院的需要,使治疗更便宜、更安全和更实用。
但这种方法受到了其他人的批评,他们担心低剂量的方法可能会留下一些未经基因编辑的细胞,使治疗效果更差。波士顿儿童医院研究血液疾病的Stuart Orkin指出,可能想得太理想化了。
Malik反驳,一旦确定高剂量是有效的,就很难减少剂量。她以癌症化疗为例:在一些癌症中,研究人员正在减少某些药物的剂量,并发现它们的效果与最初尝试的高剂量一样好,甚至更好。但她指出,肿瘤学家花了几十年才迈出这一步。她可能会摔个四脚朝天,但她还是得去尝试。因为其他人不会主动下调剂量。
Malik的试验也遇到了向资源较少的地区输出基因疗法的现实问题。她的团队获得了FDA的批准,只能在辛辛那提儿童医院进行试验。但在Malik在牙买加的一次会议上发表演讲后,一个患有镰状细胞病的人找到她寻求帮助,并描述了多次因疼痛而去医院的经历。
Malik在牙买加开展了一项合作。她觉得她们必须这么做。这个团队花了大约两年才获得必要的批准和资金。然后牙买加的临床团队遇到了另一个问题:缺乏可靠的输血血液。
今年4月,该研究小组报告称,在治疗结束后的18个月里,他们的第一个病人只经历了两次疼痛,并一直保持着高水平的血红蛋白。Malik指出,该小组已经治疗了第二名患者,还有两名患者正在排队等待治疗。
问题不仅在于费用和实用性,还在于能够处理干细胞移植的临床医生和设备的可用性。农村地区已经在努力为人们提供羟基脲(hydroxyurea),这是一种相对便宜的药物,可以降低疼痛的发生率。加州斯坦福大学(Stanford University)的人类学家Duana Fullwiley指出,很难想象这些地区有足够的人员来长期监控基因治疗的接受者。
一些人认为现在考虑这些问题还为时过早。Wonkam认为,如果我们改进这项技术,从长远来看,它将是负担得起的。现在的价格对他来说不是问题。重点应该放在效率上。
但其他人认为,现在是开始考虑基因疗法的全球推广的时候了。NIH院长Francis Collins表示,如果不这样做,“几乎是不道德的”。
Collins认为,实现NIH与盖茨基金会合作项目的关键在于找到方法,将修正后的基因或基因编辑工具植入骨髓干细胞,而不需要先收集造血干细胞,也不需要清除未修饰细胞,从而使治疗更便宜、更容易进行。这是一个雄心勃勃的目标,但偶尔也会遭到质疑。有时候会有一种模糊的感觉,‘这个目标就目前来说,有点不切实际了。
Kohn指出,已经有迹象表明,通常用于将基因运送到培养皿中的细胞中的病毒在编辑后,能实现在体内将修饰过的基因递送到造血干细胞中。这是一个伟大而崇高的目标,他认为科学发展非常快,说不定我们很快就能实现体内基因编辑,而不需要将造血干细胞抽离出来。
对Bakatunkanda来说,拯救他的是衰老,而不是药物。他表示,有些镰状细胞病患者在儿童时期的情况比成人更糟,他认为自己就是其中之一。虽然他仍然有疼痛周期,但不像以前那么频繁了。最近几个月,他参加了徒步旅行和健身等他曾经认为是应该禁止的活动。他只想知道他能把自己逼到什么程度。
但他宁愿过一种没有疼痛和中风持续威胁的生活。尽管他意识到基因疗法的前景,但也知道目前还不清楚它们是否能治愈疾病。他也希望能治愈疾病,过上正常人的生活,但目前技术还不成熟。
原文检索:
Heidi Ledford. (2019) Gene Therapy Is Facing Its Biggest Challenge Yet. Nature, 576: 22-25.
张洁/编译