透明组织推动生物学研究
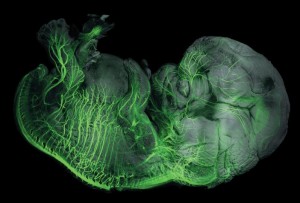
透明化的8周龄人类胚胎中周围神经(绿色)的3D图像。
使组织像玻璃一样透明,并将其放大到原始尺寸的数倍的技术,为研究生物系统内部机理提供了新途径。
今年3月,日本的研究人员从细胞水平绘制了小鼠大脑的结构,显示了前所未有的细节。
日本大阪RIKEN理化研究所生物系统动力学研究中心(RIKEN Center for Biosystems Dynamics Research)的系统生物学家Hiroki Ueda等人使用一种名为CUBIC-X的技术创建了一只小鼠的大脑图谱。基于这种方法,他们化学标记了大脑中的每个细胞,然后使组织透明化,同时使组织的尺寸放大10倍。然后,他们使用复杂的成像技术来绘制一个完整的3D神经元图谱——总共包含7200万个细胞。由此产生的图谱将大脑简化为一系列细胞地址数据库。该团队利用此图谱,探索发育过程中各个大脑区域的变化。展望未来,这一图谱可以推动更深入的大脑结构探索,例如研究控制睡眠-觉醒周期等行为的脑区。
事实上,类似于CUBIC-X的方法非常多。这些方法利用现成的化学物质为研究人员提供了一个透视大脑,甚至机体每一个组织的窗口。一些方法是单纯的使不透明的组织透明化,而其它方法还能使组织结构放大,从而在显微镜下能观察到分子细节。有许多方法可以达到类似的目的,用户在决定使用哪种方法之前应该充分了解不同方法的优点和局限性,然后根据课题性质来选择方法。
解析大脑
对组织透明化的渴望起源于神经科学家。他们一直为难以追踪大脑中轴突和树突的蛇形回路而沮丧。
这些研究常用的方法是对经过标记的脑组织的薄切片进行连续成像,然后计算重建成3D图像。但是这个过程很慢:单个小鼠脑中神经回路的成像可能需要进行数周的拍摄,并且生成的图像的质量完全受限于切片数量和质量。帕西迪纳加州理工学院(California Institute of Technology)的神经科学家Viviana Gradinaru表示,大多数情况下,你只能得到少量切片,这对重建来说效率不高。并且切片本身可能会损坏组织表面和边缘,而后续重建图像时,图片的对齐也会出现一些问题。
更好的方法是使组织透明,然后对其进行完整的成像。经过过去几十年分子试剂、遗传策略和成像技术的不断发展,科学家终于开发出了使组织透明化的方法。
当谈到解析大脑的内部回路时,脂质是最棘手的问题。当通过水溶液的光遇到脂质表面时,折射率的变化使光线弯曲和散射。Gradinaru指出,就像果冻:它主要由蛋白质组成,而且它是半透明的。但如果你给果冻中加入奶油,它会变得不透明。奶油是由脂质组成的。细胞和细胞器膜主要由脂质组成,包裹轴突的髓鞘也是如此。大脑透明化需要消除这些分子,同时稳定其余的分子。
德国解剖学家Werner Spalteholz在1911年首次展示了透明化不透明组织的策略。他采用化学溶剂处理消除了光散射生物分子。但这种方法与今天的荧光试剂不相容,并且会破坏组织结构。
2011年,维也纳技术大学(Vienna University of Technology)的脑部影像专家Hans-Ulrich Dodt、德国慕尼黑大学的Ali Ertürk和德国神经退行性疾病中心(German Center for Neurodegenerative Diseases)的Frank Bradke提出了最早的现代透明化技术之一。该方法被称为3DISCO,是Spalteholz方法的改良版,使用更温和的化学溶剂混合物来溶解脂质,同时保留细胞结构,使标本脱水和硬化成透明的结构,同时保留组织的原始结构。巴黎INSERM视觉研究所(INSERM Vision Institute)的发育神经科学家Alain Chédotal等人认为,基于溶剂的方法在再现性和成本方面是最可靠的——哪怕是第一次使用这种方法,都会成功。基于溶剂的方法通常最适合与荧光标记的抗体一起使用,因为遗传表达的荧光蛋白的信号太弱,或通过这种处理后会变性。但是,Ertürk团队在3DISCO方法的基础上,提出了一种新方法vDISCO,克服了这个问题。 vDISCO使用染料标记的“纳米抗体”来增强透明组织中荧光蛋白的信号——该团队用这种方法对整只小鼠进行了透明化和成像。
另一种广泛使用的组织透明方法是CLARITY,该方法是Gradinaru于2013年在加州斯坦福大学(Stanford University)神经科学家Karl Deisseroth的实验室读研时帮助开发的。Deisseroth实验室在其神经科学研究中广泛使用荧光蛋白,并寻求“更自然的”组织透明化方法,从而最大限度地减少对感兴趣的生物分子的损害。CLARITY使用去污剂来消除脂质,同时用形成水基水凝胶的聚合物来稳定组织基础结构。据Gradinaru解释,所有生物分子都互相连接,被锁定在蛋白质中。然后你就可以使用这种温和的洗涤剂来吸收脂质。早期版本的CLARITY在技术上具有挑战性,需要施加电场来清除包裹脂质的洗涤剂。但Gradinaru随后设计了一种更简单的替代方案,用清洁溶液灌注动物的脉管系统以达到同样的效果。
基于CUBIC系列技术,Ueda开发了另一种方法。CUBIC开发了“亲水性”化学物质,将水吸入固定的样品中,同时将溶解的脂质挤出。与CLARITY一样,该方法在澄清样品的同时保留了荧光蛋白的结构和功能。
日益增加的证据
透明化方法使研究人员能够解决过去无法解决的神经科学问题。例如,Chédotal正在使用3DISCO探索视觉系统的完整回路。他指出,以眼睛为例,神经节细胞的输出可能会传递到大脑的30个不同部位。这些轴突如何找到这些不同的目标是完全未知的。
透明化方法的使用并不局限于大脑。Gradinaru谈到自己基于脉管系统灌注的CLARITY工作时表示,令他们惊讶的是,大多数啮齿动物器官在几天内变得透明。除了皮肤和骨头之外,动物的整个身体都变透明了。在组织透明化中,骨骼是一个特殊的挑战,因为即使在常规透明化后,钙也能继续反射光线。但一些特别的处理可以解决这个问题。例如,Ueda已经证明,EDTA——一种常用的实验室化学品,能有效地去除骨骼中的钙。Gradinaru的团队还开发了一种用于透明化骨头的升级版CLARITY。
利用这些方法,研究者可以对完整标本进行全身成像。研究人员已将其应用于追踪罕见的干细胞群或肿瘤转移灶,甚至可以追踪怀孕早期人类胚胎发育中的脉管系统和周围神经系统。然而,随着样本体积变大,显微镜可能成为限制因素,因为可成像的尺寸非常小。因此,研究人员必须在研究目标与实用性之间取得平衡。激光片层扫描显微镜是一种流行的解决方案。Deisseroth认为,一层层地扫描组织,而非一个点一个点地开始扫描,可以极大地加快成像速度。因此,某些透明方法导致的样本物理尺寸收缩也能加快成像速度。在3DISCO中,脱水可以使样本体积减少到50%。对此,Chédotal指出,这意味着我们可以一次性对整个人类胚胎进行3D成像。
尽管如此,即使能缩小一半的物理尺寸,能够成像的尺寸还是非常小的。透明化了人类大脑的Chédotal只能对几立方厘米的脑区——这只占整个大脑体积的1%——进行成像。他指出,他可以让整只母牛变得透明。但如果他无法对其进行成像,那意义又在哪里呢?
尺寸放大
透明化是组织成像的一个有价值的起点,但为了得到精细的分子细节,研究人员还需要“放大”的手段。
如果两个分子之间的距离小于光的“衍射极限”(大约200纳米),那么传统的光学显微镜是无法区分的。光学显微镜的这一局限性导致了更复杂的超分辨率显微镜方法的发展。麻省理工学院(Massachusetts Institute of Technology, MIT)的神经生物学家Ed Boyden开玩笑说,为了解决分辨率问题,他最初提出了另一种方法——“炸毁”大脑。但很快他就看到了这个想法的真正潜力——细胞中的所有蛋白质都挤在一起,如果我们将它们彼此分开,也许我们可以更好地看到它们。
Boyden的研究小组进行了数十年的水凝胶特性研究。他们发现,这些水凝胶在水化过程中经历了比例膨胀。在2015年发布的第一代“扩展显微镜”(expansion microscopy)方法中,他们用特殊设计的荧光标记去识别目标靶分子,然后将标记过的样本与形成水凝胶基质的聚合物溶液一起孵育。荧光标签附着在该基质上,锁定各分子的相对位置。最后,通过化学或酶处理将周围组织破碎,并水合以使凝胶基质溶胀。由此产生的膨胀使荧光标签处于相同的相对位置,但彼此间的距离是原始距离的四倍。结果,现在可以使用标准荧光显微镜来辨别原本过于靠近而难以区分的分子。
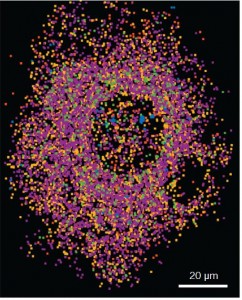
扩展显微镜图片展示了在人工培养的Hela细胞中的6个已被标记的RNA靶点。
对于许多生物学家来说,这种方法看起来好得令人难以置信。据西雅图华盛顿大学(University of Washington)的生物成像研究员Joshua Vaughan回忆,他的第一个念头是:‘这太疯狂了,怎么可能都有效?’”但他怀着莫大的兴趣尝试了这种方法,并设计了一种替代版本,使用传统的荧光蛋白或抗体,而不是专门设计的标记试剂去标记分子。之后,多个团队对此方法进行了改良,包括来自Boyden小组的迭代方法。该方法使用两轮处理来实现高达20倍的扩张,以及由MIT生物医学工程师Kwanghun Chung开发的另一种方法,该方法使生物分子变性而不是使其它们透明化,从而更好地保护它们内源蛋白质和组织结构的完整性。Chung指出,绘制大脑回路图谱需要保留神经纤维,因此很适合采用这种方法。毕竟一旦你切断神经之间的连接,就会丢失一些信息。至关重要的是,这些不同的方法还可以诱导组织透明,使用户可以在超大尺寸的样本中深入研究细节。
Vaughan的团队已将扩展显微镜应用到从果蝇幼虫到人类肾脏的一系列样本中,其他研究人员正将其应用于临床(参见文末“透明的肿瘤”)。但是,为了扩大尺寸,可能需要反复的试错和调整。Vaughan表示,人体肾脏有一些坚韧的结缔组织,所以我们不得不继续尝试使用酶来清除这一结构。组织放大过程中,确保扩张确实是“各向同性”,或在所有方向都同比例扩张,也是至关重要的。证据显示,通过谨慎的调整和反复实践,现有方法可以实现显著的“各向同性”。Chung等人的结果表明,失真小于5%,相当于或低于样品封片过程中产生的失真。
走得更远
对于资金短缺的生物学家来说,扩展显微镜可以在不购置昂贵的硬件的情况下,实现超分辨率成像。柏林自由大学(Free University of Berlin)的细胞生物学家Helge Ewers表示,基本上任何人都可以做到这一点,任何普通的显微镜都可以成为具有超能力的显微镜。至关重要的是,所需的试剂都很常规,即使有些配方需要经过一些尝试。Chédotal指出,透明整只鼠只需花费大约1美元。同时,透明化所需的设备也很常规。据Ueda介绍,你只需将器官放入化学品中,通常只需要一个培养箱和振动器——大多数实验室都有这样的设备。样本放大在技术上的要求比单纯的透明化方法要高,但Boyden和其他人已经发布了“最佳方法”,以帮助消除扩展显微镜中的不确定因素。Boyden认为,尽管这个方案还算不上通用解决方案,不过也很接近了。
研究人员开始探索这些方法的应用价值。目前一些团队正在开发一些脑图集计划,其目标是在细胞图谱的基础上,绘制细胞之间的相互关系。其他人正在对DNA和RNA进行透明和扩展,使他们能够调查基因和蛋白质表达。哈佛大学(Harvard University)的生物物理学家庄小威设计了一种基于扩展显微镜的策略,使她的团队能够量化单RNA水平上100多个基因的表达。与此同时,Deisseroth等人开发了一种名为STARmap的技术,可以直接在透明化的大脑中对多达1020种不同的基因进行直接测序。
得到的数据可以帮助对单个细胞进行分类。但它也可以与回路图谱和活体图谱进行叠加,以揭示大脑中结构和功能的相互作用,揭示以前未发现的神经连接。Deisseroth指出,组织透明化方法保留了组织中细胞的三维排列,因此我们可以将这种细胞分辨率的转录组学和连接组学数据与活体动物实时收集的细胞分辨率活动模式整合数据到一起。
透明的肿瘤
在免疫学和遗传学的新见解的指导下,癌症医学正在快速发展。然而,癌症病理学依然停滞不前,还是依赖于对单个肿瘤组织切片进行染色,然后进行显微镜检查。日本大阪RIKEN生物系统动力学研究中心(RIKEN Center for Biosystems Dynamics Research)的系统生物学家Hiroki Ueda指出,这是非常保守的,年轻的临床科学家对这种情况感到有些沮丧。
组织透明化方法提供了另一种选择。例如,在2017年,Ueda等人表明,组织透明技术CUBIC比传统的制备方法具有更高的灵敏度,使临床医生可以观察更大的组织切片,并发现可能被忽视的特征。Ueda表示,有时早期癌症会被误诊,但如果采用三维透明化的组织,我们很少会错过癌症特征。
组织透明策略还提供对肿瘤生物学的见解。加州斯坦福大学(Stanford University)的神经生物学家Karl Deisseroth和斯德哥尔摩卡罗林斯卡研究所(Karolinska Institute)的Per Uhlén应用了3DISCO的改良版方法,得到了全新的肿瘤异质性观点——这一因素可以深刻影响治疗反应。麻省理工学院(Massachusetts Institute of Technology)的神经生物学家Ed Boyden和他的团队已经证明,扩展显微镜可以提高组织透明化和分辨率,从而更准确地诊断可预示早期乳腺癌的肿瘤性病变。
Boyden和Deisseroth都建立了公司以促进其技术的临床开发,并且一些组织透明技术的从业者已经预见到传统方法的结束的开始。Ueda认为,年轻的病理学家对他们的技术非常兴奋,这是未来的趋势。
原文检索:
Michael Eisenstein. (2018) Transparent tissues bring cells into focus for microscopy. Nature, 564: 147-149.
张洁/编译