使用HCV蛋白酶调控蛋白功能
两种使用小分子调控蛋白活性的方法为哺乳动物合成生物学中长期存在的难题提供了通用解决方案。
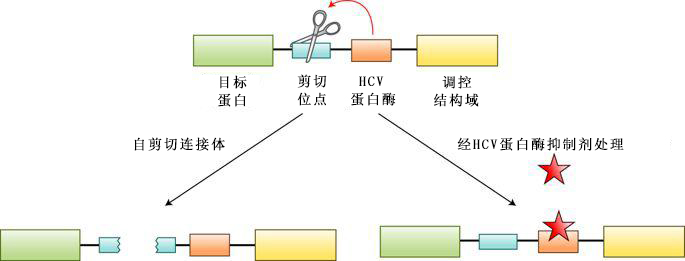
哺乳动物合成生物学由于缺乏易于编程的元件而发展不顺。尤其是,随着工程化生物系统的普及,科学家迫切需要一种对内源细胞机器进行外部控制的方法。来自Ngo和Lin实验室的论文提供了一种通用技术——使用丙型肝炎病毒(hepatitis C virus, HCV)蛋白酶介导的自切割连接体和HCV蛋白酶抑制剂来稳定连接体,控制哺乳动物细胞中蛋白质的活性(图1)。
图1 在LInC和StaPL系统中,包含HCV蛋白酶及其同源识别序列的连接体被插入目的蛋白及其调节结构域之间。自切割连接体要么释放有活性的蛋白,要么释放失活的蛋白,这取决于调节结构域的性质。经HCV蛋白酶抑制剂(红色星星表示)处理能稳定自切割连接体,从而触发目的蛋白的活化或失活。
可控生物元件的开发是合成生物学领域的一个焦点,其最终目的是为基础科学和医学应用中的生物系统提供新功能。小分子调节剂是备受欢迎的外部控制元件,它们可以实现精确的时间调控,适用于动物,甚至人类。鉴于此,许多小分子控制系统已成为蛋白质工程的主流方法。20世纪90年代早期,雷帕霉素诱导二聚化系统的发展促使其它化学诱导二聚化(chemical-induced dimerization, CID)技术大量出现。这种技术通过与小分子结合来调节蛋白质定位,或把“分裂”的蛋白组装在一起。CID的缺点是每种靶蛋白需要在小分子存在下经由二聚化过程而被有效激活,然而,当小分子不存在时,活化程度大大降低。在实际应用中,这需要对每个待控制的目标进行广泛的优化,并且仅在二聚化可以调节目标活力时起作用。
高选择性且有效的HCV蛋白酶抑制剂的开发,极大地促进了对强大的小分子诱导型控制系统的需求。健康的人类细胞中没有HCV蛋白酶。由于能够特异性地、可控地切割特定氨基酸序列,所以该蛋白酶成为了工程化蛋白酶介导的细胞活性调控的有用工具。临床上批准的HCV蛋白酶抑制剂可以应用于表达HCV蛋白酶的细胞,以选择性地调节特定靶标的蛋白水解。例如,HCV蛋白酶已被批准用于监控蛋白质合成,原理是从目的蛋白质切割出一个降解决定子,以调节蛋白质的产生。另外,我们实验室在连接体中加入了T7 RNAP抑制剂和T7 RNAP,以及一个HCV蛋白酶识别序列,使得从T7启动子处开始的转录受反式HCV蛋白酶表达的调节。尽管这些技术展示了基于HCV蛋白酶的生物技术的实用性,但是它们依赖于针对每个靶标的多组分系统和工程构建。
现在,在这两项新研究中,HCV蛋白酶和HCV蛋白酶识别位点被整合到一个连接体中。该连接体可以插入蛋白质或蛋白质融合体之间,这样HCV蛋白酶可以顺式切割HCV切割位点,就像它在HCV蛋白质组中所做的那样,然后通过外源添加的HCV蛋白酶抑制剂使自切割连接体失活,从而调节蛋白活性。简单来说,就是把自切割连接体与目标蛋白质连接在一起,连接体的蛋白水解会使靶蛋白的活性增加或降低,添加HCV蛋白酶抑制剂后,“关闭”或“开启”蛋白活性。
Tague等人称自己的方法是“配体可诱导连接”(ligand-inducible connection, LInC)。他们首先通过将自切割连接体插入到Gal4基因的DNA结合结构域和转录激活结构域之间,来验证LInC在控制基因表达上的作用。一旦连接体被表达,自切割连接体就会分离激活结构域与DNA结合结构域,产生无活性的转录因子。然而,当用各种蛋白酶抑制剂处理时,HCV蛋白酶失活,由于活性的非水解蛋白的稳定化,Gal4依赖性转录被激活。然后,Tague等人使用多个不同的DNA结合结构域很好地展示了该系统的通用性,包括靶向内源基因座的dCas9结构域和多种转录激活结构域,来开发多种小分子转录调控因子。Tague等人还使用LInC融合的膜靶向结构域,开发了“关闭”转录因子,并发现两种工程化转录因子可同时用于多模式控制。最后,他们通过小分子来控制细胞间Notch信号传导,调控细胞表面受体,证明了该方法的多功能性。
Jacobs等人将自己的方法称为“可稳定的多肽连接” (stabilizable polypeptide linkage, StaPL),StaPLs也可以被插入到靶蛋白中。他们首先构建了两种HCV蛋白酶变体,每种变体对两种不同的小分子的抑制具有选择性敏感性,最终得到两种正交的StaPL。为了验证正交性,作者使用降解标记的蛋白质,包括GFP和两种人类蛋白质,并证实了在使用与靶标对应的HCV蛋白酶抑制剂处理时,细胞中才能观察到完整的目标蛋白。在证明了两个正交StaPL-抑制剂组合能够对两个靶标进行正交控制后,作者通过将转录激活或抑制结构域连接到基因座特异性锌指结合结构域(locus-specific zinc-finger binding domains)来产生小分子活化的转录调节因子。作者以血管内皮生长因子(vascular endothelial growth factor, VEGF)合成作为模型,证明了使用两个正交的小分子可以同时双向控制VEGF抑制和激活。接下来,他们进一步证实,通过将StaPL插入dCas9蛋白的非结构化环区域,可以使dCas9转录激活因子系统受小分子调控。同样地,仅在存在小分子抑制剂的情况下,该蛋白才能稳定,并且靶向转录(即VEGF合成)才被触发。最后,作者通过诱导同源二聚化导致caspase-9激活,最终通过抑制剂处理诱导细胞死亡,进一步扩大了StaPLs的使用范围。
除了简化工程化流程外,这两种方法的关键优势在于每种工程化蛋白质仅需要表达一个基因,而不需要表达一个多组分感知系统。此外,工程化蛋白质系统不依赖于内源性降解或运输机制,这让调控结果更具可重复性,并且在多种细胞中都通用。这两种技术的一个直接应用是调控基于CRISPR-Cas9的基因组编程或基因表达调控系统,这在两项研究中都得到了验证。这些工具的另一个潜在应用是调控细胞疗法,或者作为一个死亡的开关,以产生可编程的响应。然而,应该注意的是,某个小分子在临床上被批准用于一种特定的医学应用,并不意味着在其它应用中没有脱靶效应,或者副作用在可承受范围内。然而,使用已获得临床批准的分子来开发合成生物学工具是非常有吸引力的,因为这样可以精简技术进入临床的流程。
原文检索:
Bryan C. Dickson. (2018) Controlling protein function with HCV protease. Nature Methods, 15: 489-490.
张洁/编译