新方法揭秘人类早期胚胎发育
人体外受精(in vitro fertilization, IVF)已经有40年的历史了,但我们仍然不完全了解如何确保健康胚胎的生成,并防止在体外培养过程中出现不希望的遗传或表观遗传变化。一旦胚胎被移植到子宫中继续妊娠,就难以对之后的胚胎发生和胎盘形成的初始阶段进行研究。早期发育中的错误可能导致植入问题,胎儿缺陷和胎盘不足,导致早期妊娠中止。小鼠研究为早期胚胎发育的主要遗传和表观遗传事件提供了线索。但小鼠和人类之间存在显著的形态和遗传差异,这使得跨物种比较的研究非常棘手。最近的一些实验方法,包括直接使用人类胚胎或胚胎干细胞,以及非人灵长类胚胎,为研究早期人类胚胎的发育开辟了新的途径。
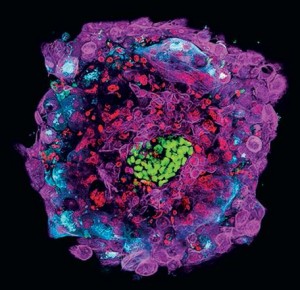
最近对早期人类胚胎的单细胞基因表达(RNA测序)分析提供了发育进程的分子时间过程。通过这种方法,科学家发现了扩展囊胚(胚胎期第5天(E5)空化囊胚)中的三种不同的细胞谱系:外滋养层(outer trophectoderm, TE)、外胚层(epiblast, EPI)和封闭内细胞团(enclosed inner cell mass, ICM)的原始内胚层(primitive endoderm, PrE)(图1)。虽然许多细胞谱系标志物,如CDX2(caudal-type homeobox protein 2)、POU5F1(POU domain, class 5, transcription factor 1)和SOX17(SRYbox 17)在小鼠胚胎发育中保守表达,不过表达时间有差异。在人类中,在扩大囊胚阶段之前不易通过转录谱分离这三种细胞谱系,但在小鼠中,在囊胚空化形态学事件之前ICM和TE的转录谱是不同的,因此是可以分离的。在小鼠中,囊胚的外层细胞会分化成32细胞阶段胚胎中的TE细胞。相比之下,完全发育的人类囊胚的TE细胞仍然能够再生整个囊胚。这些观察结果表明,人类胚胎的谱系分离发生在囊胚形成后,而小鼠的谱系分离是逐渐进行的。
图1 体外培养12天后的人类囊胚模拟了移植后发育的细胞层。
如果这个结论属实,那么就意味着小鼠和人类之间的谱系分离差异对驱动谱系分化的上游信号事件的跨物种比较有影响。例如,在囊胚形成之前小鼠胚胎的外部和内部细胞之间Hippo信号传导的差异在引导ICM分化成TE过程中起重要作用。然而,在人类中,是否存在相同的途径则尚不清楚。此外,成纤维细胞生长因子(fibroblast growth factor, FGF)信号传导的差异是引导小鼠ICM分化成EPI和PrE的关键,但阻断人类胚胎中的FGF信号传导并不影响PrE的形成,这表明其它信号通路可能与此谱系决定相关。这一发现的意义在于,需要提供体外关键信号条件以确保IVF胚胎的正确发育。
直接评估早期胚胎中的基因功能可以确定小鼠和人类之间的差异的重要性,但是直到CRISPR-Cas基因编辑技术出现后,科学家才能完成这类实验。少数几个区域允许在早期人类胚胎中进行实验性基因编辑,以探索基因功能和生殖细胞基因矫正对遗传疾病的治疗效果。人类胚胎中POU5F1的基因编辑实验结果显示,该基因被敲除的突变胚胎无法发育到囊胚阶段。这表明相比于小鼠,POU5F1在人类发育的更早阶段发挥了作用。
尽管直接在IVF条件下培养的人类胚胎中研究囊胚阶段之前的早期发育是可行的,但是胚胎植入后的发育研究就需要新的技术。最近,科学家已经在2D培养系统中培养出了囊胚,并达到了EPI、羊膜和卵黄囊形成的初始阶段。尽管这些培养的胚胎组织结构不佳,并且未能在10到12天后继续发育,但通过改善细胞外基质和培养条件可以支持人类胚胎发育至下一个里程碑阶段——原肠胚E14形成。目前这类实验并未开展,因为全球几乎普遍禁止培养14天以上的完整人类胚胎。14天标志着神经系统发育的开始。鉴于14天以上的培养有可能为早期发育的关键事件提供新的见解,目前监管机构正在就是否应该重新审议14天规则问题进行讨论。
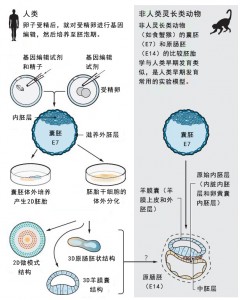
鉴于对人类胚胎培养的伦理担忧以及体内植入后发育阶段研究的不可获得性,科学家在考虑使用替代模型来开展人类早期发育的研究。人类和非人类灵长类胚胎的形态特征之间非常相似(图2)。对食蟹猴(cynomolgus monkey)移植后胚胎的研究揭示了羊膜形成、滋养细胞发育(形成胎盘)、生殖细胞形成和原肠胚形成过程的细节,以及支持这些事件的一些关键基因表达的时间和空间位置。尽管非人灵长类动物的胚胎可能适合进行直接实验,并且可能用于基因修饰实验,但这些研究在技术上具有挑战性,并且还伴随着动物伦理和护理问题。此外,非人灵长类胚胎在多大程度上可以被认为是人类胚胎实验的替代物还存在疑问。
最近,已有研究表明培养人多潜能胚胎干细胞(embryonic stem, ES)可以产生胚胎样结构(胚状体)。在人类多潜能胚胎干细胞的微模式培养(micropatterned culture)中,2D细胞类型和相关基因表达谱都与小鼠胚胎胚层中的有序模式类似。这些模式的构造并不能完全重现原肠胚标志性的3D结构。相反,3D基质中多潜能干细胞的培养可以产生能重现EPI和羊膜形成的胚状体结构。
在小鼠中,3D培养的ES细胞会产生类原肠胚结构。这些结构不仅具有EPI,而且还有局部化的原始条纹状结构和前-后组织模式(胚胎发育中前侧和后侧细胞会分化成不同的细胞谱系),这是原肠胚阶段胚胎的独特特征。在没有胚外组织(如滋养层和PrE)的情况下发育到这种组织程度是非常有意义的,因为胚外组织通常会提供局部信号以引导细胞定向分化。此外,联合培养ES细胞和滋养层干细胞(trophoblast stem, TS)可以模拟一些胚胎-胚外组织的相互作用,并且能够产生类似于囊胚的类囊胚和类似于原肠胚前胚胎的类胚体。这些发现进一步证实了人类ES细胞和人类TS细胞的联合培养可能为人类发育提供近似度较高的实验模型。在这个关键时刻,迫切需要解答的问题是:这些胚胎样结构的发育是否足够类似人体胚胎的体内发育,这些模型得到的结果是否与早期人类发育具有科学上的相关性。未来需要直接对人类胚胎进行研究,以建立一个发育研究的范例,以作为这些胚胎样实体发现的评估依据。
图2 胚胎发育的实验研究。
人类胚胎学研究的目标是获取关于早期人类发育的细胞和分子机制的基础知识,并促进其在生殖技术、基因编辑、干细胞研究和预防遗传性出生缺陷方面的应用。虽然这些知识最好从研究人类胚胎上获得,但人体IVF胚胎研究必须遵守关于“适度”和“同意”的伦理、法律和实践原则。许多管辖区禁止以研究为目的地去创造胚胎,这其实也禁止了某些实验的可行性,例如受精和合子形成前的生殖细胞基因编辑。未来,干细胞衍生的胚胎样结构或许足以取代人类胚胎,成为人类发育研究的模型系统,为人类早期发育提供最有用的见解。
随着用于产生干细胞衍生的胚胎样结构的技术提高,这些生物构建体将更接近人类胚胎。这就出现了一个问题:这些实体是否会受到与人类胚胎一样的道德限制?体外发育的14天限制是否会应用于这些胚胎样培养物?14天规则的胚胎学知识是基于人类胚胎的罕见数据和小鼠发育和形态学研究总结得出的,而不是基于人类胚胎的实验发现。如果人类类胚胎和原肠胚可以在14天后继续发育,那么14天规则可能就毫无意义,并且限制了相关研究的进展。因此,在考虑是否维持或修改14天规则之前,为了测试科学价值以及伦理和法律实用性,必须对人类早期胚胎发育和替代性的胚胎学模型进行严格控制的研究。
原文检索:
Janet Rossant and Patrick P. L. Tam. (2018) Exploring early human embryo development. Science, 360: 1075-1076.
张洁/编译