DNA修复:神经退行性疾病的共同机制
科学家们认为,DNA修复是神经退行性疾病中的共同机制。这提示,靶向DNA修复可能可以治疗神经退行性疾病。
神经退行性疾病在全球越来越普遍,这对日益老年化的社会来说,是巨大的负担。研究突出了一些共同的机制,包括异常和错误折叠蛋白质。但是基于这些共同点的细胞机制依旧复杂。本期《自然》(Nature)杂志中,Hoch等人指出,他们发现了一种新的神经退行性疾病,其发病机制与DNA修复有关;他们的结果强调了,DNA修复异常可能是各类神经退行性疾病的共同机制。
Hoch等人的第一个研究对象是一名47岁的女性。在过去19年里,她患有进行性神经综合征,主要体现在步态不稳定,以及难以协调眼睛和四肢运动。这些性状与小脑和基底神经节中的神经变性一致。Hoch等人发现,该妇女的XRCC1基因发生突变,导致编码的XRCC1蛋白的水平降低。他们还发现,另一名无关的类似症状的患者也存在XRCC1基因突变。他们称这种综合征为XRCC1共济失调性运动失调(AOA-XRCC1)。
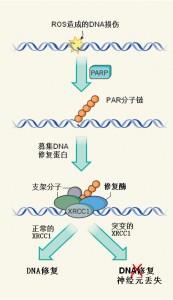
有害的活性氧(ROS)氧化会造成DNA和DNA碱基的单链断裂,细胞内存在修复这种损伤的分子机器,而XRCC1是其中的关键部分。DNA修复过程的第一步是通过PARP(poly ADP-ribose polymerase)合成poly-ADP ribose(PAR)分子链。PAR链在受损的DNA部位募集一些支架因子,包括XRCC1和ATM蛋白(ATM在另一种神经退行性疾病运动失调性毛细血管扩张症中发生突变)。这些蛋白反过来招募修复DNA损伤所需的酶(图1)。
图1 纠错机制中的错误。ROS可能造成DNA的单链断裂。为了修复这些断裂,PARP酶合成PAR分子链。PAR链会募集XRCC1等支架蛋白到DNA损伤处,随后进一步募集DNA修复酶。Hoch等人报道称,人类XRCC1基因的突变会引起DNA修复缺陷,导致神经元功能障碍和死亡,机制可能是影响该DNA修复复合体的功能和超活化PARP。
Hoch等人证明,患者细胞中单链断裂修复的水平比正常人细胞低得多。接着,他们使用大脑中Xrcc1基因被敲除的小鼠研究了XRCC1突变可能导致神经变性的机制。这些小鼠出现明显的小脑退化,相关的运动和协调功能也发生变化;PARP活性也有增加。
PARP在AOA-XRCC1中的作用是什么?Hoch等人同时敲除了小鼠的Xrcc1和Parp基因,他们观察到,相比于仅敲除Xrcc1的小鼠,这些小鼠的行为变化和小脑退化有明显改善。这表明PARP活性或过度激活是AOA-XRCC1的介导因素。不过其中的潜在机制仍然不明确,可能是XRCC1突变或XRCC1蛋白水平过低造成DNA修复能力减弱,从而引起PARP活力增加。PARP过度激活可能引起DNA上过多形成DNA修复复合体,从而进一步削弱DNA修复能力。这会形成恶性循环,进一步增加PARP活力。研究人员建议,抑制PARP活性的药物可能治疗AOA-XRCC1和其它神经变性疾病。
DNA修复已涉及几种其它罕见的遗传疾病。到目前为止,所有与DNA修复相关的疾病似乎都有进行性运动障碍的特征,这通常伴随着小脑或基底神经节中神经变性的发生。部分疾病是由作用于DNA链末端以修复单链DNA断裂的酶的突变引起的。
有趣的是,DNA修复机制似乎也在亨廷顿舞蹈病(Huntington’s disease)中扮演了重要角色。亨廷顿舞蹈病患者的亨廷顿蛋白由于突变,末端谷氨酰胺组成的“尾巴”过长,导致基底神经节发生退化。过长的谷氨酰胺末端,导致蛋白构象发生异常,容易在脑内发生聚集,形成蛋白斑块(这与阿兹海默症和帕金森病中的蛋白异常聚集非常类似)。亨廷顿病的发生年龄是高度可变的,主要取决于谷氨酰胺尾巴的长度——尾巴越长,发病越早。但全基因组分析发现了几个可以影响发病年龄的基因组区域——这些区域似乎主要包括与DNA修复相关的基因。
另一项遗传研究发现,DNA修复酶也可以改变其它几种由聚谷氨酰胺过度延长引起的神经退行性疾病的发病年龄。此外,DNA修复机制也在这类聚谷氨酰胺延长相关的疾病中扮演重要角色,但DNA修复缺陷调节这些疾病的详细机制需要进一步研究。也许DNA附近突变聚谷氨酰胺延伸蛋白的异常聚集会抑制修复酶的募集和释放,从而干扰DNA修复。
现在,DNA修复与谷氨酰胺过度延伸疾病之间的关联已经日渐清晰。亨廷顿蛋白突变的小鼠与缺乏一个拷贝的ATM的小鼠杂交,减轻了后代亨廷顿舞蹈病相关性状的严重性。此外,亨廷顿蛋白在DNA修复期间,与ATM形成复合物,该复合物募集XRCC1和其它因子到氧化性DNA损伤的位点。
DNA修复缺陷如何导致神经变性?一种可能性是,随着时间的推移,异常的DNA修复导致DNA氧化损伤的进行性累积。这种损伤会导致DNA和表观遗传修饰(可以在不改变DNA序列的情况下,改变DNA的表达)的广泛变化。随着时间的推移,这些变化可能导致正常神经元功能的丧失,并且最终DNA损伤水平将超过阈值,激活P53等维持基因组完整性的因子,从而触发程序性细胞死亡和神经元死亡。
这些研究以及Hoch等人的结果,提出了一种可能性——DNA修复机制是不是与阿尔茨海默病和帕金森病相关。阿尔茨海默病患者的大脑中的确存在氧化DNA的缺陷修复。也许,阿兹海默症的发病年龄由DNA修复缺陷和正常老化期间发生的ROS水平提升来决定。值得注意的是,阿兹海默症影响的是大脑的皮质和海马体,而不是基底神经节和小脑。然而,至少有间接证据表明,阿尔茨海默病中存在异常DNA修复机制——例如,患者脑脊液中氧化DNA碱基的水平确实有所升高。
PARP、ATM、p53和其它DNA修复相关蛋白将来可能会成为神经退行性疾病的治疗靶点。25年前,人们治疗这些疾病时关注的焦点是DNA和遗传研究——如今我们又绕回了原点,重新回到DNA上。进一步的研究,将更详细地阐明这些机制,并确定针对DNA修复的治疗是否可用于神经退行性疾病。
原文检索:
Christopher A. Ross & Ray Truant. (2017) DNA repair: A unifying mechanism in neurodegeneration. Nature, 541 (1038): 34-35.
张洁/编译