初级医疗的未来
美国正在进行一项雄心勃勃的尝试,他们要将基因组学筛查项目纳入乡镇医疗常规服务当中。
现年38岁,在美国Geisinger医学中心从事护士工作的Dana Atkinson(化名)又哭了,因为她想起了今年1月接到的那个电话。正是这个电话给她和她的三个孩子的未来蒙上了一层阴影。她一直在尝试消化这个噩耗,这对她来说太难以接受了,尤其还牵扯到她的孩子们。
几个月之前,在她们医院的一次常规体检中,医生抽取了Atkinson的血样。在取得了她的同意之后,医生将血样送到美国纽约的Regeneron生物科技公司(Regeneron Pharmaceuticals in Tarrytown, New York)进行全外显子组测序。到了今年冬天,Atkinson的电话响了。医生告诉Atkinson,她携带了一种罕见的突变,这种突变与长QT综合症(Long QT syndrome)有关。这是一种心律失常性疾病,它可以引起患者晕厥(fainting)、癫痫发作(seizures),甚至死亡。
医生在电话里并没有透露太多的信息,只是建议Atkinson尽快去找他咨询。虽然Atkinson是医务工作者,但她还是不太理解医生在电话里说的情况。不过她明确的是,她和她的孩子们都有可能患上长QT综合症。这让她想起她已经过世了38年的母亲。在生下Atkinson之后6周,这位母亲就在睡梦中离开了她的孩子。虽然尸检没有任何发现,但值得一提的是,因长QT综合症致死的患者身体上也不会留下明显的痕迹。
随后,Atkinson来到美国宾夕法尼亚州Forty堡的一家医学中心约见遗传学咨询师。咨询师表示,虽然她携带了这种突变,但并不一定会发病。即便她真的患有长QT综合症,医生也可以帮助她,将该疾病可能带来的风险降到最低。咨询师同时告诉Atkinson,她有哪些亲属可能也会携带这种突变。虽然Atkinson也给她的孩子们做了基因检测,但是她还没有将这一切告诉她的家人,因为她觉得还没有准备好。
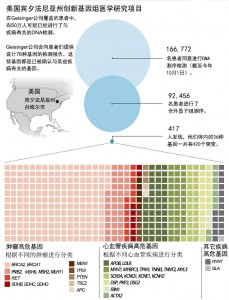
近两年来,除了Atkinson之外,在美国宾夕法尼亚州还有400多人接到了类似的电话、邮件,或者短信。因为他们全都参加了世界上最大规模的临床基因组学测序研究项目,这也是普通美国人第一次可以在初级医疗保健机构里进行基因组学检测。这个名为“我的基因编码社区医疗项目(MyCode Community Health Initiative)”的活动就是由美国丹维尔(Danville)的Geisinger卫生系统公司(Geisinger Health System)来执行的。目前他们已经对92400名美国人进行了全外显子组测序。超过16.6万人登记参加了这个项目,该项目的目标是,让非营利医疗机构的330万名患者中的50万人参加这个项目。Geisinger卫生系统公司会向每一位参与者咨询同一个问题,即如果发现了与疾病相关的异常突变,他们是否愿意让公司告知检测结果。大约有85%的志愿者都表示愿意,他们也因此成为了GenomeFIRST Return of Results实验项目的参与者。
除了使用基因测序结果来预防和治疗疾病之外,Geisinger卫生系统公司还希望能够回答一些科学问题,比如缺乏遗传学背景知识的初级医疗机构的医生如何针对与疾病有关的突变,给出相应的遗传咨询意见,以及为这些人的亲属给出意见。这个研究项目也引起了一些争议,比如是否应该将所有检测结果告诉受试者?应该告诉他们多少真相?美国斯坦福基因组学及个体化医学中心(Stanford Medicine’s Center for Genomics and Personalized Medicine in Palo Alto, California)的所长Michael Snyder认为,这就是基层医疗未来的发展方向。毫无疑问,我们应该将每个人的基因组学测序结果用于他们的患病风险评估。
除了伦理、医学和科学等方面的问题之外,大家更关注的一个问题是,如此大范围地开展基因组学测序,并将其作为一种预防性措施是否经济。目前,Regeneron公司承担了所有的测序费用,作为回报,他们将可以使用Geisinger公司的数据和病历资料等信息,但是这种操作模式不可能在全美国范围内推广。
美国华盛顿大学(University of Washington in Seattle)的David Veenstra一直在研究如何在医疗服务中使用基因学技术和数据。据他介绍,美国全基因组测序的成本将大幅度降低,这主要是保险公司的作用。因为这些保险公司希望确定,基因组学检测不会让医疗服务费用变得不可持续。Veenstra目前正与Geisinger公司开展合作,利用GenomeFIRST项目的数据进行成本效益分析,他认为,在5年内,我们就会针对是否需要在公共卫生服务领域引入全基因组测序服务这个问题,开展一场大讨论。
早在19世纪初,在这个雄心勃勃的医疗实验计划的实施地——美国宾夕法尼亚州西北部的山区里,就布满了铁矿和煤矿。到了19世纪中叶,铁矿产业已经成为了丹维尔的支柱产业。钢铁巨头George Geisinger的遗孀Abigail Geisinger在1915年伤寒疫情爆发期间,创办了Geisinger医院。经过了几十年的发展,Geisinger医院成为了当地最大的医疗集团。该集团旗下一共有13家医院,以及2家研究中心。现在,Geisinger医院的医生们已经不再需要为伤寒的问题头疼了,2型糖尿病、肥胖和毒品依赖则成为了他们的主要敌人。
2001年,Geisinger医院向美国芝加哥大学(University of Chicago in Illinois)生命科学学院的院长,外科医生Glenn Steele伸出了橄榄枝。作为美国医学科学院(National Academy of Medicine)的成员,Steele教授在肝癌和结肠癌方面都颇有建树,并花费了数年在芝加哥大学建起了全美最顶级的人类遗传学研究项目,鉴于此,当他决定投身基层医疗时,同事们都大吃一惊。Steele教授还想拉他的同事们一起去宾夕法尼亚,可是被他们婉拒了。
Steele教授看重的就是Geisinger公司遗传学数据大金矿的潜力。Geisinger公司早在1990年就开始使用电子病历。由于当地居民相对稳定,流动性不大,所以该公司已经收集了当地好几辈人的数据。这种家系数据对于研究遗传疾病来说是一笔非常宝贵的财富。Steele教授认为,Geisinger公司可以利用这些数据重新改写医疗格局。他表示,在这个地方,你能够亲眼看到好几代人的归宿,世界上除了冰岛等少数几个地区,再也不可能有这种事情发生了。
来到Geisinger公司以后,Steele教授立即建立了人群健康中心(center for population health),来研究该地区的疾病发病率。2006年,为了加快发现致病基因的速度,Geisinger公司的3位科研人员——表观遗传学家Walter “Buzz” Stewart、分子生物学家David Carey,以及病理学家Glenn Gerhard成功说服Geisinger公司共享出300万患者的血样和组织样品,建立了生物样品库。2007年,“我的基因编码社区医疗项目”招募到第一名志愿者,当时Geisinger公司并没有告诉志愿者们是否携带了疾病相关突变,志愿者只是同意Geisinger公司可以对他们的血样和组织样品进行科学研究。不过随着2013年GenomeFIRST项目的启动,这一切发生了改变。参加研究项目的志愿者需要填写一份知情同意书,同意Geisinger公司将与个人健康相关的检测结果告知志愿者本人,以及他们的保健医生。
随着参加实验的志愿者人数的不断增加,Geisinger公司在2014年和Regeneron公司签署了合作协议,Regeneron公司将免费为Geisinger公司提供基因测序服务。Geisinger公司会同时分析这些志愿者的病历记录和基因检测数据,从中找出基因突变与疾病的关系,同时也为疾病的治疗指明方向。如果真的开发出了新药,Geisinger公司则会将盈利继续投入非营利医疗机构的运行过程。
据Geisinger公司临床基因组部门的负责人Michael Murray介绍,目前,GenomeFIRST项目会为志愿者提供76个基因的突变信息。这些基因一共与27种疾病相关,其中就包括了乳腺癌和心脏病。所有这些疾病都是可以通过预防措施、生活方式干预,或者内外科手段进行治疗和干预的。诸如APOE4基因(该基因与阿尔茨海默病相关)突变这类目前还无法进行医学干预的基因的检测结果,则不会告知志愿者。初期研究发现,大约有3.5%的志愿者会获悉他们的基因发生了与某种疾病相关的突变(Science, 23 December 2016, p. 1549)。Murray希望,他们这个研究可以产生深远的影响。
如果复查的结果证实真的发生了突变,那么这名受试者的初级保健医生也会收到一份报告,相应的检测报告也会添加到受试者的病历档案中。同时还会提醒保健医生,学习相应的资料,以了解这种突变的风险,并学会如何与他们的患者进行沟通。Atkinson的医生Stephanie Cabello最开始就认为,跟患者沟通遗传检测报告肯定很困难,不过后来她发现,有了Geisinger公司的指导,其实挺简单的。
在医生们接到通知后大约一周,患者也会收到Geisinger公司发来的提醒电话或者邮件,内容是:“我们在您的DNA里发现了一个非常重要的情况,这事关您和您家人的身体健康,特此提醒您。”
这个提醒并不会告诉接收者他们的基因都发生了哪些突变,只是要求他们联系Geisinger公司。在电话里,研究协调员会用一段简短的介绍告诉接收者,发现了基因突变,可能会增加他患上某种疾病的风险。Geisinger公司也鼓励志愿者们提供更详细的家族史,同时也鼓励志愿者们将Geisinger公司给他们发的信息转发给自己的亲戚,这些信息包括对检测结果的详细介绍,以及进一步的建议。而且协调员也会告诉接到电话的志愿者们,可以去找自己的保健医生,或者专业的遗传咨询师以寻求更专业的建议。
不过事情的发展并非预期的那么顺利。2016年,Cabello医生的一位男病人得知他携带了突变的BRCA2基因。虽然我们知道,这种突变基因与女性乳腺癌和卵巢癌有关,但是这种突变基因也会增加男性罹患多种癌症的风险。Cabello医生原本以为可以帮助这位患者做更详细的癌症筛查,可是患者的反应却让她大吃一惊。据她回忆,这名患者完全对她们的建议不感兴趣,这太可怕了。患者告诉Cabello医生,当他想听的时候再跟她说。可是14个月过去了,他也没有再来找过医生。
有很多家庭的亲属并不在Geisinger医院的所在地,而是遍布全美各地。Coal镇的居民Patrice Molesevich以前是一名护士,后来加入Geisinger公司成为了一名医疗病历管理人员,并于2015年3月参加了GenomeFIRST项目。一年之后,她也接到了电话,得知她的BRCA2基因发生了突变。
Molesevich表示,她知道她会得癌症,因为她哥哥在37岁时死于胰腺癌,她的父亲死于前列腺癌,Molesevich的家族成员也有很多癌症患者,癌症类型包括结肠癌、肺癌和喉癌等。不过这个检测结果还是让她大吃一惊,因为到目前为止,她家还没有人得过与BRCA2突变基因有关的乳腺癌或者卵巢癌。
随后Molesevich找到Geisinger公司的遗传咨询师。该咨询师表示,Molesevich有85%的机会患上乳腺癌,7%的机会患上胰腺癌。核磁共振扫描发现,Molesevich的左乳真的有一个早期的癌变病灶。于是Molesevich接受了双侧乳腺切除手术,同时开始服用阿纳托司唑(anastrozole),以进一步降低未来患上乳腺癌的风险。
遗传咨询师还建议Molesevich的两个孩子,以及她的兄弟都来做一下BRCA2基因检测。结果Molesevich的女儿很幸运,没有发现突变基因,而他的儿子则拒绝做检测。
Molesevich又联系了她的妯娌Kerry Georgeadis,也就是他1992年死于胰腺癌的哥哥的遗孀,她们家也有3个女儿。Georgeadis的态度非常坚定,她从未想过,这么多年以后,她们家还会和癌症打什么交道。不过既然有这种风险,就应该尽一切可能,积极面对这一切。首先,Georgeadis找到了她住在纽约的二女儿——已经30岁的Lynsey Towne 。Towne的妇产科医生给她做了检测,结果非常好,她没有携带这种突变基因。
Georgeadis的大女儿,33岁的Ashley Meskill就没这么幸运了。鉴于她在美国长岛的医生对于遗传检测并不太熟悉,所以让她到当地的一个小型肿瘤医院看看。最终检测结果为阳性,Meskill是BRCA2突变基因携带者,可是她的遗传咨询师只是简单地给她算了算患上各种肿瘤的风险,这让Meskill感觉她自己被判了死刑一样。这场遗传检测只是给Meskill带来了一大堆的焦虑。现在,她转到了美国纽约的纪念斯隆凯特林癌症中心(Memorial Sloan Kettering Cancer Center in New York City),她正在逐字逐句地研读检测报告。
Georgeadis的小女儿,25岁的Cydney Engle也到纪念斯隆凯特林癌症中心做了BRCA2基因检测。今年3月,她也得到了一个坏消息,于是她也做了双侧乳腺切除手术。对于Engle和Meskill姐妹俩而言,这个检测报告提醒她们,应该用一个更加健康的生活方式,积极地面对生活。目前她们正在练习跑马拉松,也注册了@brca_sisterhood这个Instagram账号,在互联网上与其他的BRCA2突变基因携带者积极互动。
Geisinger医疗中心的遗传咨询师Heather Rocha正在和患者Jeffrey Mowery做遗传咨询。
有些人认为,Geisinger公司透露的信息只是九牛一毛。最开始,该公司根据美国医学遗传学院(American College of Medical Genetics, ACMG)在2013年公布的、已经确认与疾病有关,而且目前有相应医疗处置措施的基因名单,对56种基因进行检测。在与Geisinger公司,以及美国其他多家科研机构的临床遗传学家们做了交流之后,Murray等人又在检测基因名单里加了3个与鸟胺酸氨甲基转移酶缺乏症(ornithine transcarbamylase deficiency)和遗传性出血性毛细血管扩张症(hereditary hemorrhagic telangiectasia)这两种疾病有关的新的基因,以及17种与心血管疾病有关的基因,着让整个检测名单共有76种基因。美国波士顿儿童医院(Boston Children’s Hospital)的医学遗传学家,同时也是ACMG专门跟踪这个项目的工作组成员之一的David Miller表示,他见过这份检测名单,他不认为有什么很激进的地方。
而斯坦福的Snyder则认为,Geisinger公司还不够激进。最近,Snyder对70人进行了全外显子组测序,发现有12个变异与人体健康有关。而其中有一半的基因都不在ACMG公布的名单(该名单目前已经列名了59种基因)当中。Geisinger公司提供的检测报告里也不涉及这些基因的检测内容。Geisinger公司的检测报告也不会提供与隐性突变(recessive mutations)有关的信息。这些隐性突变虽然对携带者无害,但是如果他们的后代同时携带了两个隐性基因,那么就会患上囊性纤维化病(cystic fibrosis)一类的疾病。所以Snyder认为,人们有权利知道这些检测结果,也有权利知道与阿尔茨海默病有关的检测结果。
美国匹兹堡大学生物伦理及健康法律中心(Center for Bioethics & Health Law at the University of Pittsburgh in Pennsylvania.)的主任Lisa Parker认为,是否可治疗,并不是我们在撰写遗传检测报告时唯一需要考虑的因素。
不过,美国北卡罗来纳大学教堂山分校承认肿瘤临床检测服务中心(Adult and Cancer Clinical Genetics Services at the University of North Carolina in Chapel Hill)的主任James Evans则警告道,临床医生和普通公众不应该被这些“例外的”事件误导,从而产生一种错误的认知,认为就应该出于医疗的目的,在健康人群中普遍开展DNA检测。Evans认为这种冒进想法是非常危险的。
Evans进一步指出,到目前为止,只有少数几个人群大规模筛查研究,比如结肠筛查项目(colorectal center screening)、巴氏涂片检查(pap smears)和乳腺钼靶检测(mammograms)等检测项目被证实有效。当开始在健康状况还不是特别明确的人群中开展这些遗传学检测项目时,你其实就是冒险将他们暴露于后续的有创检测中了。
美国人类基因组研究院医学基因组学和代谢遗传学分院(Medical Genomics and Metabolic Genetics Branch at the National Human Genome Research Institute in Bethesda, Maryland)的院长Leslie Biesecker认为,哪怕这些“患者”并没有受到什么伤害,但他们也付出了金钱和时间的成本。比如,如果有人知道他体内携带了与Lynch综合症有关的突变基因,那么他就会频繁地做结肠癌筛查,这的确可以在早期就发现病灶,及时处理。可是Biesecker指出,有多少人需要去做DNA测序,花多少钱,来发现这个有可能致病的基因呢?
目前,进行全基因组测序的费用为数千美元/人,但这还只是刚开始。后续的检测也是需要成本的,而且准确性如何还值得商榷。光一个假阳性就可以带来很多不必要的手术和其它检测,这些也都是需要花费大量经济成本的。
卫生经济学家们常常会用质量调整生命年(quality-adjusted life years, QALYs)来评价整体人群的健康状况,简单来说就是评价人一生中有多少年是健康的。目前在美国,通常认为每增加一个质量调整生命年的花费如果不到10万美元,那么就是值得的。可是据英国牛津大学(University of Oxford in the United Kingdom)的卫生经济学家James Buchanan介绍,到目前为止,还没人知道在低危人群中进行疾病相关基因筛查的成本是否低于10万美元。
美国哈佛医学院(Harvard Medical School)的初级保健医生Jason Vassy等人最近就这个问题提交了一些非常珍贵的数据,他们对50名健康的成年人进行了跟踪调查,这些人总共对4600个基因进行过测序,平均费用是5000美元。Vassy等人要求这50人再根据基因检测的结果做两次后续的检查。结果发现,这种“体检”是非常不经济的,相关的文章于今年的8月1日发表在《内科学年报》(Annals of Internal Medicine)杂志上。
可是,Vassy也指出,Geisinger公司的这种做法可能会更加经济,因为Geisinger公司是有针对性的、对已经有相应医疗处置措施的疾病基因进行检测。Vassy认为,这是一种非常严谨的方式,它可以在人群中寻找高危个体,并且给予相应的医疗处置。
每个人的行为都是难以预测的,这也给成本效益计算增加了难度。美国布朗大学Warren Alpert医学院(Brown University’s Warren Alpert Medical School)的医学统计学家Glenn Palomaki专门研究了产前筛查(prenatal screening)和遗传学检测的结局。他指出,如果检查结果出来之后,突变基因携带者不做任何处置,那么这种检查就是毫无意义的,纯粹就是浪费钱。可是如果突变基因携带者反应过度,那么也会因为过度医疗而浪费更多的金钱。如果检查结果为阴性,比如没有发现突变的BRCA基因,那么被检者也有可能因此而放松了警惕,不再进行常规的体检(比如乳腺钼靶检查)。长期来看,这样反而会增加她们的健康风险,增加医疗花费。Geisinger公司的科研人员将利用GenomeFIRST项目的数据尝试着回答这些问题。
有些人认为,很多感觉身体很健康的成年人会抗拒做遗传学检查。如果他们真的被查出了什么问题,很可能会陷入抑郁和焦虑的境地。Biesecker认为,Geisinger公司的这个研究项目就很好地回答了这个问题,因为参与这个项目的大部分都是这样的健康成年美国人。
Biesecker指出,参与这个项目的人都非常愿意做遗传学检测,也很想知道自己的检测结果。如果这种方式可以让他们活得更加健康,他们都是非常愿意接受的。
至于在收到突变检测报告之后会有什么样的反应,这就比较复杂了。据GenomeFIRST项目的负责人之一,遗传咨询师Adam Buchanan介绍,大约有一半的人在接到通知之后会去做专业的遗传学咨询,有四分之一的人会去找自己的初级保健医生咨询,还有四分之一的人则暂时不做任何处置。
自1990年开始就在Geisinger公司工作的Mark Speake医生介绍,所有这些参与我们研究工作的患者们都非常配合,都非常乐于参与这个项目,这也是为子孙后代造福的好事。Speake医生认为,这个项目对糖尿病、肥胖症、高血压、高血脂、甲状腺等疾病尤为重要。因为这些疾病往往都是家族聚集性发病,也是美国社会中最为多见的疾病。Speake医生有三位患者都检查出了突变,他认为这并不奇怪,患者也没有必要为此而担忧,因为这个检测报告只是一份报告,现在对他们而言,家族史更加有意义。
以色列和新加坡,以及美国Kaiser Permanente公司等其他医疗服务系统也都在密切关注Geisinger公司的进展,随时准备调整自己的医疗服务策略。不过Speake认为,Geisinger公司的策略并不一定适合其他的系统,包括政府医保系统。然而,他认为这是一个很好的开始,因为检测是免费的。Speake相信很多人都会记得乔治·奥威尔写的小说《1984》,同时也担心会出现小说里的那些问题。不过患者是会相信他们的,相信他们只是为了患者的健康着想,而不是去窥探更多的信息。
GenomeFIRST项目还涉及儿童,这部分工作目前还在继续。在整个项目中有2~3%的参与者是儿童,有些甚至是新生儿。Murray等人正在建设一个咨询系统,以为这些儿童的家长们提供更好的帮助。
Atkinson就是一个很好的例子。今年5月,她的一个女儿被确定没有遗传她的长QT综合症基因,但是她那两个热爱体育的儿子(分别为9岁和12岁)都是携带者,这种小男孩是最容易在青春期,在剧烈运动时发生猝死的(女孩的高危年龄是20多岁)。
Atkinson已经带她的大儿子去看了心脏病专科,也做了心电图检查,同时也佩戴了2周的心脏监护仪。结果发现,他的确是长QT综合症患者。心脏病医生建议他服用beta受体阻滞剂类药物,以降低心律失常的发病风险。Atkinson还花2500美元买了一台自动体外除颤仪备用,不过这笔费用是不能用医保支付的。
根据Atkinson现有的检查结果来看,她自己还不是长QT综合症患者。但是基于她们的家族史,她也开始服用beta受体阻滞剂类药物了。她的小儿子也开始定期做心电监护。虽然我们还需要几年才能够知道,Geisinger公司这个项目的结果,才能够知道是不是应该在健康人群中进行基因筛查,但是Atkinson现在就认为应该这么做。
原文检索:
Bijal P. Trivedi. (2017) MEDICINE’S FUTURE? Science, 358: 436-440.
Eason/编译