如何重写基因组?
在成功修饰细菌和酵母的基因组后,合成生物学家们开始研究如何编辑更复杂的生物体,如人类的基因组。
在典型的实验室条件下,大肠杆菌(Escherichia coli)菌株JF1看起来和其它菌株并没有什么差别——都像是琼脂平板上黄色的飞溅物。但当JF1菌落置于红色、绿色或蓝色光下,JF1细胞会将培养基中的化学物质转化成带有不同颜色的物质,产生模糊却绚烂的美丽图案。
麻省理工学院(Massachusetts Institute of Technology)的Christopher Voigt团队通过构建复杂的基因回路,实现了这一“魔法”。这项成果于2017年5月发表在《自然化学生物学》(Nature Chem. Biol.)杂志上。该研究中,Voigt团队利用这种技术重现了荷兰艺术家M.C. Escher的蜥蜴——一幅色彩缤纷的几何插图。他指出绘制蜥蜴图案只是为了好玩,而且可以展示合成生物学中最先进的方法。但用大肠杆菌做颜料并不容易:调控基因的回路包含18个基因和32个调节元件,它们分布在4个质粒上,即46198个碱基对上。该基因回路使大肠杆菌可以响应红光,绿光和蓝光。Voigt表示,要实现这些功能,基因回路就会比较复杂。
经过基因修饰的酵母在不同波长光的照射下,能发出不同颜色的光。
除了Voigt,还有很多合成生物学家在做类似的探索。CRISPR技术大大降低了合成和编辑DNA的成本,并提高了精度。该技术帮助生物学家从头开始构建或重新设计微生物的基因组,如大肠杆菌和啤酒酵母(Saccharomyces cerevisiae)。合成生物学研究人员现在正在探索如何重编程复杂生物体——包括人类——的基因组。例如,大量的DNA操纵会带来技术上的挑战。同时,尽管DNA合成成本下降,但是如果需要重写数十亿个碱基,那么合成成本仍然很高。
麻省理工学院林肯分析实验室(MIT Lincoln Laboratory)的合成生物学家Peter Carr指出,过去两年的成果大大鼓舞了他们,他们有信心在动物上做一些重大的基因编辑。
Carr在2015年给《生物技术趋势》(Trends in Biotechnology)杂志写的信中问道:“合成生物学的发展速度会碰到声障,还是能达到光速?”(注:直机翼飞机在飞行速度接近声速时,会出现阻力剧增,操纵性能变坏和自发栽头的现象,飞行速度也不能再提高,因此人们曾以为声速是飞机速度不可逾越的障碍)这个问题采用了修辞学,因为合成生物学也有其固有极限——例如,细菌生长速度是有限的。但是,合成生物学中的障碍正在演变。几年前的幻想技术现在已然实现。
曾几何时,研究人员们纠结于克服生产几千克DNA的障碍,如今他们正在以兆碱基的规模重建基因组。2016年3月,测序和合成生物学先驱Craig Venter等人宣布,他们重写了蕈状支原体(Mycoplasma mycoides)的基因组,将其原有的100万碱基删减到53.1万碱基,创造了支原体生存所必须的“最小基因组”。
2016年8月,哈佛医学院(Harvard Medical School)的遗传学家George Church团队和实验室博士后研究员Nili Ostrov发表论文指出,他们合成了一种名为“rE.coli-57”的细菌。研究人员将该细菌中的7个密码子——编码特定氨基酸的核苷酸三联体——剥离,然后使用遗传重编码技术植入同义替代物。2017年3月,美国哈佛大学维斯生物启发工程研究所(Wyss Institute for Biologically Inspired Engineering)的生物化学家Pamela Silver团队首次重新编码鼠伤寒沙门氏菌(Salmonella typhimurium)LT2菌株的基因组,取代了大约20万个碱基,并消除了特定的亮氨酸密码子,此举旨在防止病原微生物之间的基因转移。
最大的基因组改良来自于纽约大学朗戈医学中心(New York University Langone Medical Center)的Jef Boeke和约翰霍普金斯大学(Johns Hopkins University)的Joel Bader领导的国际联盟。2017年3月,该团队发表论文,对酿酒酵母(S. cerevisiae6)16条染色体中的5条进行了重写——这是名为“合成酵母基因组计划”(Synthetic Yeast Genome Project, Sc2.0)的国际项目的里程碑式事件。Sc2.0旨在优化和合成酵母的整个基因组,以用于工业和纯研究应用。Boeke表示,例如,通过去除非编码蛋白质(内含子)的所有DNA序列,该小组可以评估内含子在细胞中起到的作用。
人工设计的Sc2.0酵母染色体通过删除重复的序列和内含子,将编码蛋白翻译机器关键片段的序列移位到特定染色体上,同时清除TAG密码子(一种终止翻译的密码子),换上另一种终止密码子TAA,以确保染色体的精简和稳定,并为蛋白工程提供了便利。此外,他们还通过一个名为BioStudio的定制软件包来管理Sc2.0团队的相关遗传数据。
Sc2.0项目的国际协调人、英国爱丁堡大学(University of Edinburgh)的Patrick Yizhi Cai表示,Sc2.0的运算负载很大。Boeke实验室的博士后、负责合成6号染色体的Leslie Mitchell指出,相比之下,编辑酵母染色体就比较简单,孵化器中只需要几片酵母。
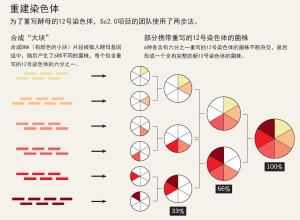
Sc2.0团队使用一种名为SwAP-In的策略逐个重写染色体(图“重建染色体”)。研究人员首先将被称为寡核苷酸的DNA单链分子组装成约750个碱基的“小块”,然后组装成1万个碱基左右大小的“中块”,然后将“中块”组装成3万—6万个碱基的“大块”。每个大块都包含两个标记基因中的一个——携带URA3基因的酵母,可以在没有尿嘧啶的情况下生长,而携带LEU2基因的酵母可以在缺少亮氨酸的情况下生长。然后,他们通过同源重组将“大块”植入现有的染色体中。同源重组后,新的标记基因取代了原有片段的标记基因,使酵母细胞可以轮流在缺乏尿嘧啶和亮氨酸的培养基中生长。定量PCR分析确定染色体重写完成后,研究人员开始测试得到的酵母菌株在相对严格条件下形成菌落的能力:与野生型相比,基因改良后酵母生长减慢,更易死亡,这表明还需要克服修复问题。据Mitchell解释,整个流程就是把大块整合进入染色体,测试性能,然后再重复这个过程。
基因积木
Mitchell指出,不出问题的话,单个“大块”可以在两周内完成合成和测试。Boeke表示,花在性能测试和“调试”(纠错)上的时间要比合成长得多。他还指出,目前完成的几条染色体,存在少数几个显著的错误。一些源自基因组注释的错误,另一些则由密码子替代引起了错误,例如,改变了RNA的二级结构。
大多数情况下,酵母基因改良都是比较顺利的。Sc2.0遇到的一些障碍反映了另一个更大规模修改基因组的项目——基因组计划书(Genome Project-write, GP-write)——可能遇到的问题。除了明显的规模问题——人类基因组有30亿个碱基对之外,要比酵母的碱基数大两个数量级——生物体越复杂,基因组注释也越少。当Venter的团队首先尝试在M. mycoides中建立最小基因组时,他们应用了合理的设计,使用已发表的遗传数据来编制基本基因列表,然而最终失败了。Venter指出,他们缺乏基本的生物知识,即使是最简单的细菌基因组,包含的生物知识也是巨大的。Venter等人后来采用了自上而下(自下而上是合成DNA,然后导入到细胞中;自上而下是在细胞中直接进行基因编辑)的方法,最后得到了一个由473基因组成的最小基因组。但其中约三分之一基因的功能仍处于未知状态。Silver认为这个结果很让人振奋。
但相关挑战还有很多。Sc2.0和其它基因组重写项目倾向于避开基因的调控区域,但在诸如真核生物等复杂的生物体中,这些调控区域可能距离其调控的基因比较远,且没有被充分研究。因此,研究人员可能不知道哪些序列可以重写,哪些部分需要保留。同时,研究者们也不确定这种大规模的基因组变化是否会影响染色质结构,从而影响基因表达。
在实际层面上,染色体大小的DNA分子在不被破坏的情况下是非常难以操控的,并且没有有效的方式将其输送到大多数真核细胞中。即使科学家可以递送DNA到目标区域,这些DNA也可能无法整合到基因组中,因为大多数真核细胞不像酵母那样轻易地进行同源重组,而且真核细胞生长较慢,会拖慢试验的每一步。
同时,还要考虑合成DNA的成本。Silver的团队获得了美国国防高级研究计划署(US Defense Advanced Research Projects Agency)的资助,用于研究鼠伤寒沙门氏菌的基因组重编辑。因此,Silver团队经过和供应商讨价还价,拿到了一个有利的DNA合成价格。Silver表示,DNA合成的价格是0.10美元/碱基,完成她的项目将花费100多万美元。而人类基因组的成本是这个项目的几百倍。
不过Church指出,技术不断进步,DNA合成成本也会不断下降,这只是时间问题。他的猜测是,随着时间的推移,构建大型基因组将会越来越简单。
精准重写
到目前为止,基因组重写写入的都是天然存在的基因。生物学家希望最终能赋予细胞一些新的功能。
包括大肠杆菌和鼠伤寒沙门氏菌基因组重写在内的几个项目正在着重于基因重新编码,即从细胞中剔除某个密码子,然后另作他用。Jason Chin是英国MRC分子生物学实验室(MRC Laboratory of Molecular Biology)的合成生物学家,他在操控遗传密码上做了大量工作。Chin指出,这种重新编码可以推进蛋白质工程,以及以标准氨基酸以外的单体为原料的新化学聚合物的设计、测试和合成。其它可能的应用包括生物控制(防止生物体在实验室外释放)和遗传隔离(保护生物免受病毒感染)。
早在2005年,Farren Isaacs还是Church实验室的博后时就开始研究大肠杆菌基因组重编码,并集中精力寻找终止密码子TAG的替代物。Isaacs现在是耶鲁大学(Yale University)的生物工程师。
因为大肠杆菌只含有321个TAG密码子,所以Isaacs能够通过修改现有的基因组来完成这个任务,而不是从头开始合成不含TAG密码子的基因组。Isaacs等人首先将大肠杆菌基因组划分为32个片段,并将每个TAG密码子改为同义密码子TAA。该过程中使用的名为多重自动基因工程(multiplexed automated genome engineering, MAGE)的策略,可以一次编辑多个DNA序列。接下来,他们利用细菌之间的遗传交换的自然过程将32个修饰的片段加入到单个分子中。为了完成重编码过程,该小组删除了编码RF1蛋白的基因,RF1可以识别密码子TAG。(相关蛋白RF2,则识别密码子TAA)。去除这一必需基因后,大肠杆菌仍然存活,这显示该团队的重编程起效了。
对于许多研究人员来说,改写基因组所有必须的技术都已具备。马萨诸塞州剑桥的eGenesis公司正在使用基因编辑工具CRISPR将猪转化为可移植器官的来源。据该公司的共同创始人Luhan Yang解释,这个想法是使用CRISPR去除猪基因组中编码可能引起人体免疫反应的蛋白质的序列。同时还可以引入编码有助于使猪组织与人体相容的蛋白质的新基因。她们认为修饰几十个基因可能就够了。
然而,对于更大规模的项目,这种方法仍然是行不通的。例如,Ostrov和Church的大肠杆菌项目需要剔除分别编码丝氨酸、亮氨酸和精氨酸的TAG终止密码子和两个密码子,以产生一个包含57个密码子的菌株。该工作需要62214个基因位点修饰,该团队使用自下而上的DNA合成,而不是自上而下的基因编辑。Ostrov表示,要修饰的位点太多了,还不如直接合成基因组。
这些基因组重写研究都没有直接合成一个连续的、大小为一个染色体的DNA。提供DNA合成的供应商依赖于几十年前的合成方法,无法产生长于200个核苷酸的DNA片段。Church的团队和大多数追求基因组合成的团队一样,把目标染色体分成几个部分,分别合成,之后再组装在一起。Church购买长度在2000-4000个碱基的DNA片段,然后在酵母中将这些片段整合成长度为5万个碱基对长的“中块”,随后他们将这些完整片段转移到大肠杆菌中。最终,他们剔除了大肠杆菌基因组的相应区域,并测试了所得菌株的适应性。
根据Ostrov的说法,编码过程顺利进行,尽管存在一些错误。例如,改变特定基因的编码序列时无意中抑制了邻近基因的启动子活力,降低了菌株的适应性。
Chin表示,基因组中存在很多特殊的信息,研究人员只能通过实验来一一解密。
基因回路
其他研究人员正在开发赋予基因组新功能的遗传回路。通常,这些回路(例如Voigt的酵母发光回路)设计都比较简单,只需使用转录因子作为阳性或阴性输入/输出信号便可以了。但是波士顿大学(Boston University)的生物医学工程师Wilson Wong却独辟蹊径,使用重组酶来反转或删除DNA片段——这种策略名为BLADE(Boolean logic and arithmetic through DNA excision,通过DNA切割进行的布尔逻辑和运算)。
Wong表示,BLADE省略了将各个回路连接(一个回路的输出必须与下一个回路的输入相匹配)的麻烦。
在一次演示中,Wong等人创建了一个布尔逻辑查找表——一个约长1万个碱基的遗传回路,在6个重组酶的作用下,可以转变成任意16个可能的逻辑门。
Wong的团队基本上是用铅笔和纸张来设计这一回路的。但最终,合成生物学家希望以电子计算机构建设计。为解决这一问题,Voigt与波士顿大学(Boston University)的电气工程师Douglas Densmore合作开发了一种名为Cello(cellocad.org)的工具。研究人员使用Verilog编程语言来指定遗传回路设计,而Cello则计算出对应的DNA序列。
Voigt指出,尽管这看似简单,但是微生物基因组遗传控制的精妙程度却让人难以置信。 研究过程中,他们反复受到自然存在的调控网络的打击。但是通过基因组编辑、基因组合成和设计工具的结合,研究人员终将克服层层困难。
原文检索:
Jeffrey M. Perkel (2017). Cell engineering: How to hack the genome. Nature, 547: 477-479.
张洁/编译