令人痛苦的肿瘤嵌合体
缩短一名年轻人寿命的融合蛋白(Fused proteins)有望帮助我们解决好几种对儿童最致命的肿瘤。
就在儿子Max被查出罹患肿瘤的那一天,Ariella Ritvo冲进了医院的病理科,要求亲自查看病理切片。面对惊呆了的病理医生,Ritvo强调,他16岁的儿子Max还躺在那,不给他看切片,确认病情,他是不会离开的。
在显微镜下,Ritvo看到了被染成蓝色的细胞,这也是她和Max在接下来的9年时间里将要对付的敌人。Max患上的是一种非常罕见的儿童肿瘤——尤文氏肉瘤(Ewing’s sarcoma)。他将接受无数次化疗、多次手术,还尝试了几种实验性药物,包括两种肿瘤疫苗,以及一种从未在人体上使用过的药物。他的肿瘤细胞甚至被移植到小鼠体内,构建了转移瘤病理模型。
令人遗憾的是,病魔还是夺去了Max的生命,这全都因为一种可怕的蛋白质。
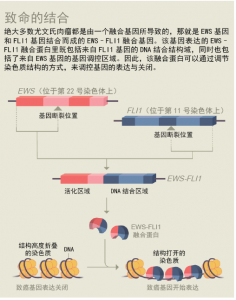
与其他尤文氏肉瘤患者一样,Max体内的肿瘤细胞也含有一种融合基因,即由两种基因合并而成的一个基因。这种基因表达的融合蛋白名为EWS–FLI1,它是一种致命的嵌合体蛋白(chimaera),EWS–FLI1改变了数千种基因的表达。
这种融合蛋白常见于儿童肿瘤,比如脑瘤和白血病等。Max的命运也表明,这是一个非常棘手的问题。这类表达融合蛋白的肿瘤往往也是侵袭性非常强的肿瘤,而最常采用的强力化疗方案毒副作用又太大了。通常来说,我们很难研究儿科肿瘤,这首先是因为儿科肿瘤不那么常见,其次是出于伦理方面的考虑,不太适合拿儿童来做试验。不过最让我们痛恨的一点就是,虽然这些融合蛋白已经成为了很多新型抗癌药物的作用靶点,但后来却发现,它们非常“狡猾”。据美国佛罗里达州Moffitt肿瘤中心(Moffitt Cancer Center in Tampa, Florida)的儿科肿瘤专家Damon Reed介绍,大多数肿瘤都不会直接告诉你:‘快看,这是我的阿喀琉斯之踵(Achilles' Heel)’。它们只会静悄悄地在躺在那儿搞破坏。
科学家们没有放弃,一直满怀希望并为之努力。最近几年,他们又发现了好几种与EWS–FLI1蛋白类似的融合蛋白,这些蛋白都能够与一些细胞基因表达调控事件发生相互作用。这些表观遗传调控机制已经成为了(成年人)肿瘤研究里的一大热点。相关的疗法已进入临床试验,并取得了不错的成绩。受此鼓舞,研究人员启动了一项新的、针对儿科肿瘤开展系统性相关研究的科研项目。
25年来,美国俄亥俄州哥伦布市全美儿童医院(Nationwide Children’s Hospital in Columbus, Ohio)的儿科肿瘤专家Stephen Lessnick一直在研究尤文氏肉瘤。他认为,儿科肿瘤研究领域的前景将会一片光明,这将是一个前所未有的、不能错过的好机会。
聚光灯下的杀手
尤文氏肉瘤的早期症状通常都不太引人注意。以Max为例,早在2007年他就感到背部有点疼痛。但作为一位16岁的空手道黑带高手,这好像没什么值得大惊小怪的。
可是后来,Max开始发烧,当时他们以为这是一场普通的感冒。可是后来Max连呼吸也变得了困难,对此,Ariella警惕起来,决定马上带Max去医院检查。结果医生从Max的肺部抽出了2升积液。随后的活检证实,Max患上了尤文氏肉瘤。
每一年,全世界有1400万人被确诊为癌症患者,其中有30万人是19岁以下的青少年儿童。从这个数字看来,儿科肿瘤的发病率并不太高,鉴于此,政府和制药企业都没有特别重视这个群体。所以美国波士顿市Dana-Farber肿瘤研究所(Dana-Farber Cancer Institute in Boston, Massachusetts)的肿瘤遗传学家Matthew Meyerson认为,这就是导致儿科肿瘤药物研发滞后于成年人肿瘤药物研发的原因,但不应该是这样。
值得庆幸的是,儿科肿瘤的治愈率要远高于成年肿瘤患者。儿科肿瘤患者的5年生存率超过了80%,而且绝大部分患儿都可以被治愈。比如儿童急性白血病治疗方面的进展,已经成为了肿瘤治疗领域最大的进展。
但是儿科肿瘤的治疗也可以是非常激进的。肿瘤医生们会给这些患儿使用大剂量的(这种剂量足以杀死一名成年人)化疗药物,这是因为患儿们的病情非常容易反弹。不过伴随而来的是,患儿不幸夭折(但是这种死亡有时就是药物引起的)之后家长的绝望。据统计,大约有3%的癌症患儿死于治疗本身。
据Max的主治医生Lessnick 介绍,你想尽办法治疗疾病,但这些儿科肿瘤确实是非常难治的疾病。
Max发病的年龄也是一个不利的因素,这使得他的死亡风险非常高。青少年处于一种中间状态:一方面,他们不再像小孩子那么“年轻”,因此,青少年的治愈率也会低一些。另一方面,他们又不如成年人那么“老”,因此很难参加新药的临床试验(治疗成年人的新药临床试验数量要远远多过儿科用药的临床试验数量)。
满怀希望
1992年,Max还是一个婴儿,同年,法国巴黎一家实验室首次对EWS–FLI1基因编码的蛋白质进行了测序。一年后,美国加州大学洛杉矶分校(University of California, Los Angeles)的一个科研团队发现,这个融合蛋白极有可能就是导致肿瘤的元凶。他们发现了FLI1蛋白(该蛋白具有调控基因表达的能力)与EWS蛋白融合之后获得了新的功能——基因表达调控的能力更强了。Lessnick就是在1993年以博士研究生的生份进入了这个研究领域。当时他们实验室对这个研究领域充满了信心。大家好像都非常乐观,感觉很快就会发现攻克癌症的奥秘了。由于大家只在肿瘤细胞里发现过EWS-FLI1融合蛋白,因此从理论上说,以该蛋白为治疗靶点的药物是不应该像传统的化疗药物那样,对人体有毒副作用的。
据Lessnick 介绍,当时大家都有一个非常清晰的共识,即他们已经找到了致癌基因,因此要做的就是想办法关闭这个基因的表达,这应该不是什么难事。可是25年过去了,他们还在原地打转。
在那个时候,有一小部分非常敬业的科研人员几乎筛查了所有能够与EWS-FLI1融合蛋白发生相互作用的分子和药物。他们希望通过这种方式找到能干干扰EWS-FLI1融合蛋白活性的药物,但是这个对手太狡猾了,它的结构非常松散、不固定,因此很难与外源药物稳定地结合在一起。于是,又有人想尝试关闭EWS-FLI1融合基因的表达,比如使用RNA干扰等技术,但这又会面临另外一个问题,即无法保证干扰RNA分子能够进入所有肿瘤细胞,并有效地发挥应有的作用。哪怕只有一条漏网之鱼,也会像星星之火燎原,使肿瘤病情复发。
这一方案失败之后,科研人员们又开始将目光瞄准了EWS-FLI1融合蛋白那数百个调控靶基因,希望从中找到对肿瘤病情至关重要,同时又能够被药物干预的靶基因,作为治疗的靶点。
终于,科研人员们找到了IGF-1R这个蛋白。能够与该蛋白特异性结合的抗体已进入临床试验阶段。但最终的结果还是让我们失望了,临床缓解率只有10%。由于这种药物的商业价值非常小,因此制药公司决定终止该药物的开发工作。
Reed表示,经过一次又一次的碰壁,如果再有告诉他发现了一个下游信号分子,能够影响EWS-FLI1融合蛋白的功能,他一定会转身离开。因为这个方法,他们已经尝试了数百万次了。
2010年左右,科研人员们又开始尝试另外一种方法,即从全基因组的角度入手,查看是否会有一些新发现。比如有人希望通过对尤文氏肉瘤进行全基因组测序,找出其中的突变序列,查看是否能够以此作为治疗靶点,对疾病进行干预。结果有3个实验室都得出了同一个结果,即尤文氏肉瘤细胞几乎都含有融合蛋白,大多数情况下是EWS-FLI1融合蛋白,但也不全是。到目前为止,也没有什么药物作用靶点能够覆盖大部分尤文氏肉瘤患者。
不过,虽然得到了这样一个阴性的结果,但我们还是能够从中看到光明的一面的。很多成年肿瘤都充满了突变,因此很难确定其中哪些突变才是致癌突变,哪些只不过是对肿瘤的生长没有作用的背景突变。肿瘤也可以有很多启动因素,这也让肿瘤治疗变的更加复杂。Dana-Farber研究所的儿科肿瘤学家Kimberly Stegmaier认为,简单的肿瘤基因组(比如尤文氏肉瘤那样的工作)信息不能为我们提供太多有价值的靶点,但是如果致癌基因比较少,那么从理论上来说,产生耐药性的机会也应该少一些。因此,从这个角度来说,还是有希望的。
刻板的疗法
但是有希望并不代表有成果。尤文氏肉瘤治疗方法就是一个很好的例子。自1993年起,这个领域几乎没有取得任何进展和改变。目前的治疗手段还是老三样,几轮猛烈的化疗,再加上手术和放疗。2007年,Max开始接受化疗,每一次化疗为期三周,周而复始。在第一周化疗刚开始,他就出现了剧烈的呕吐和腹泻等副作用,而且还出现了消化道感染的迹象。到了第二周,他又出现了严重的贫血。第三周是恢复治疗,然后再开始新一轮化疗。经过四轮化疗之后,Max又接受了手术、放疗,以及其它药物治疗。
Max用他固有的幽默感,勇敢地面对这一切,除了异环磷酰胺(ifosfamide)这一种药物。这种药物让他产生了幻觉,而且无法正确地用语言表达他的意思。他只能机械地重复两句话:“我的脑子要裂了。” 和 “给我那个蓝色的药!” 这个蓝色的药就是亚甲蓝(methylene blue),这是专门拮抗异环磷酰胺的药物。
疗程结束之后,Max坚决地向他妈妈表示,他再也不吃这种药了。
好消息是,Max的病情也得到了缓解。与其他少年一样,接下来的5年里,Max也坠入了爱河,有了网瘾(最后也戒掉了网瘾),开始热爱诗歌和哲学等。
但是曾经是肿瘤病人的这个经历也给他留下了烙印。他在进入耶鲁大学(Yale University in New Haven, Connecticut)的第一年,就一直认为,因为过去曾服用异环磷酰胺,所以他的记忆力受到了损害。这种想法一直折磨着他,使他成为了一名诗人,据他后来介绍,他是在用写作保留记忆,他害怕如果不写下来,以后就会忘记这一切。
在大学的最后一年,Max的情绪终于稳定下来了。他甚至还与其他人合作,搭建了一个喜剧社。Max的诗歌创作范围不再局限于记录自己的想法。但是他最想忘记的那件事却始终没有放过他,那就是他的疾病。2012年,Max的肿瘤复发了。Max的妈妈在耶鲁大学附近租了一间公寓,每天负责在学校和医院之间接送他。
就在那个时候,研究尤文氏肉瘤融合蛋白的科研人员们也取得了进展。当时,美国斯坦福大学(Stanford University in California)的生化学家Cigall Kadoch等人正在研究一大类可以对染色质结构进行调控的蛋白质。我们知道,染色质的结构是可以打开和关闭的,当它打开时,其中的基因就可以表达,而关闭之后,其中的基因也就不能表达了。
2013年,Kadoch等人发现,一种名为SS18的蛋白质参与构成了一个复合体,该复合体能够调控染色质的结构,使其打开或者关闭。如果SS18蛋白质与SSX蛋白质发生融合,那么形成的融合蛋白也会具有SS18蛋白质的功能,但这样一来,就破坏了正常的染色质调控机制。Kadoch等人还发现,这些融合蛋白会极大低促进致癌基因的表达。他们的这项研究成果也向我们揭示了融合蛋白在滑膜肉瘤(synovial sarcoma)中的致病作用机制。
该研究成果同时也进一步丰富和印证了融合蛋白与表观遗传学(epigenetics)之间的关系。研究白血病和尤文氏肉瘤的科研人员也有了类似的发现(见图“致命的结合”)。目前Kadoch在Dana-Farber的肿瘤研究所工作,他经常会接到来自其他从事融合蛋白研究工作的科研人员们的咨询和求助。Dana-Farber肿瘤研究所的儿科肿瘤学家Scott Armstrong一直在研究儿童白血病与表观遗传学之间的关系。据他介绍,Kadoch的研究发现也是他们第一次发现融合蛋白与染色质调控复合体之间的关系。
由于这种联系也是表观遗传学研究领域的热点,所以再次让大家对靶向这些融合蛋白的精准治疗燃起了希望。对成年人肿瘤进行的基因组测序研究也证实了表观遗传学对于肿瘤的发生和发展具有十分重要的作用。科研机构和制药企业也都在针对这些成体肿瘤相关的表观遗传学蛋白质开展靶向治疗研究。现在,儿科肿瘤学家们都希望能够参与这些新药开发的工作,为治疗儿童和青少年肿瘤尽一份力。
比如,有一种名为BRD4的在研新药就是专门抑制这些表观遗传学蛋白质的。该药物有望治疗一大类由融合蛋白引起的疾病,比如多种白血病和横纹肌肉瘤(rhabdomyosarcoma )等疾病。这种策略也可以应用于EWS–FLI1融合蛋白,因为该融合蛋白也能够与表观遗传学调控因子——LSD1蛋白发生相互作用。Lessnick 正在美国休斯敦市的Salarius 制药公司(Salarius Pharmaceuti- cals, a company in Houston, Texas)担任首席医学官。目前该公司正在开发LSD1蛋白抑制剂,并且希望开展临床试验,以检验该药物治疗尤文氏肉瘤的效果。
绝望的时刻
Max和他的妈妈Ariella已经非常了解所有这些试验项目了。Ariella在美国纽约也运行了一个基金会,名为Alan B. Slifka 基金会(Alan B. Slifka Foundation in New York City )。这是一个慈善组织,由Ariella已经故去的丈夫(他专门为犹太社区提供资助)提供资助。Max生病之后,Ariella扩大了Alan B. Slifka基金会的资助范围,并将尤文氏肉瘤的研究工作也包括在内。
这一对母子也积极地参加了尤文氏肉瘤患儿家庭网络机构。Ariella经常给大家分享有关的小知识,也常常澄清一些谣言。Max最好的一帮朋友们也在帮忙分担他的痛苦。
从积极的角度来看,Max病情复发的时机还算不错,当时他已经22岁了,因此可以参加未成年人不能参加的临床试验了。对此,Ariella也感到非常高兴。但是一些不公平的事情也一直在困扰着她。据她介绍,很多患儿可没时间等到18岁。他们还未成年就已经故去了。
2012年,Max又开始了新一轮的化疗,他总共需要接受12个疗程的治疗。Max的医生还是建议他使用异环磷酰胺,但是被他拒绝了。在接下来的4年里,Max一次又一次地接受了临床试验。Ariella为此向美国食品与药品监督管理局(FDA)提出申请,要求FDA提供特别许可,允许尝试使用一款还不能在儿童身上进行试验的免疫药物。大家认为,这种药物对于突变数量较少的肿瘤(比如尤文氏肉瘤)效果不会太好,因为通常的观念都认为,只有发生突变了的蛋白质,才会刺激机体的免疫系统,产生免疫反应。Max的试验结果也显示,该药物加快了肿瘤在他体内的进展。
2015年,Ariella和Max将Max体内的肿瘤标本送去一家生物公司。该公司的研究人员用这些肿瘤细胞构建了小鼠移植瘤动物模型,然后用这种动物模型进行药物筛查试验。结果,他们发现了一种药物的效果很不错。
素食主义者Max得知这一结果之后,心情非常复杂,一方面他感到非常神奇,另外一方面,也觉得非常不安,因为为了拯救他的生命,而让试验小鼠失去了生命。拿到试验结果之后,Ariella第一时间找到FDA,要求他们允许Max使用这些药物。但很遗憾的是,这些药物对于Max并没有任何帮助。
在此期间,Max又拿到了硕士学位,并且组建了自己的家庭,还开始出诗集。他一直在积极地参加一个又一个的临床试验,但是随着病情的进展,他也变得越来越消瘦了。2016年7月,这位身高1.8米的小伙子的体重只有51公斤了。
来得太迟的希望
Max还是小孩子的时候,每周一他都会爬到妈妈的床上,和妈妈一起躺在床上看卡通片。这已经成为了他们家的规矩,他称之为“周一家庭犬日(family dog Monday)”。
然而2016年8月中旬,改由Ariella来到Max的床边。Ariella和Max的妻子Victoria仔细地照看着Max,不时地给他捶捶背,帮助他清理肺部。Max的呼吸声让Ariella非常担心,因为虽然Max已经失去了意识,但是这种呼吸声表明,他的肺里充满了积液。
2016年8月23日,Max终于停止了呼吸。Ariella擦干净Max的身体,等着护理人员把他推走。
当时距美国肿瘤登月计划(US Cancer Moonshot)的顾问宣布将要攻克融合蛋白问题才刚刚过去半个月。这对于儿科肿瘤医生来说不仅仅是解决融合蛋白问题的大好机会,同时也是让儿科肿瘤被人们关注的大好机会。
美国孟菲斯市圣犹达儿童研究医院(St. Jude Children’s Research Hospital in Memphis, Tennessee)的院长James Downing是肿瘤登月计划建议稿的撰写人之一,他表示他们希望关注最该被关注的问题。
肿瘤登月计划的建议稿初稿完成于2016年9月,稿中建议对肿瘤相关融合蛋白(cancer-associated chimaeric protein)进行系统性的研究,并计划采用Kadoch等人的生化实验方法。此外,研究人员还需要更好的细胞培养技术和动物模型,这些也一直是阻碍该研究领域发展的难题。
Lessnick每个月都会和其他从事尤文氏肉瘤研究的科研人员们召开一次电话会议。他们在会上会坦诚地进行交流,从不担心同行之间的竞争。Lessnick表示,他们彼此之间没什么可防备的,他们还有很多事要去做呢。
虽然经历了25年的失败和挫折,但是Lessnick依旧保持着乐观的态度。他希望肿瘤登月计划能够让更多的科研人员,比如从事表观遗传学研究的科学家们参与进来,提供更多的思路和观点。他认为在此之前可没有这么好的沟通和交流的渠道。
在Max最后的日子里,Ariella让她的基金会更加关注较接近临床使用阶段的研究工作,防止错过任何一个挽救Max的机会。不过现在,她又开始关注基础研究了。因为Ariella认为,这才是最需要她们关注和支持的领域,而且用她自己的话来说,她现在可是有大把的时间了。
原文检索:
Heidi Ledford. (2017) Cancer’s cruel chimaeras. Nature, 543: 608-611.
Eason/编译