CRISPR起源的五个谜题
原核生物使用CRISPR-Cas系统来抵抗病毒,例如图中细胞上形成这种结构的病毒。
它来自哪里?生物体如何在不自我损伤的情况下,利用CRISPR?它还有其它作用吗?
虽然Francisco Mojica不是第一个看到CRISPR的人,但他可能是第一个为它着迷的人。Mojica始终记得,1992年的一天,他第一次看到了这个即将启动生物技术革命的生物免疫系统。Mojica当时正在分析嗜盐微生物Haloferax mediterranei的基因组序列数据,并注意到14个异常的、都为30个碱基长的DNA序列。它们的阅读顺序从前往后或从后往前都是相同的,而且每隔35个或更多个碱基就会出现重复。很快,他发现了更多类似的序列。Mojica对此非常着迷,并在西班牙阿利坎特大学(University of Alicante)重复了他的研究。
当时这项发现并不是很受欢迎,Mojica的实验室好几年都没有拿到基金支持了。在会议上,Mojica抓住每个机会,询问那些“牛人”关于奇怪的重复性小序列的看法。但他得到的答案都是,“不要在乎这些重复的小序列”、“生物体中存在很多重复的小序列,我们早就知道了。只是不知道这些序列的作用。”
如今,科学家们对成簇的、规律间隔的短回文重复序列(CRISPR)已有了较为深入的了解。这些序列帮助CRISPR-Cas细菌系统抵御外来入侵病毒。虽然大多数生物医学利用CRISPR-Cas9系统进行基因编辑,但Mojica和其他微生物学家更关注的还是CRISPR的一些基本问题:CIRSPR系统是如何演变的?它是如何影响微生物的进化的?为什么只有部分微生物使用CRISPR系统?CRISPR是不是还有其它未知的、重要的作用?
加州大学(University of California)生物学家、首批使用CRISPR系统进行基因编辑的科学家之一的Jennifer Doudna指出,媒体对CRISPR系统的大量关注,主要是重视其作为技术的使用。CRISPR系统的确带来了很多新机遇和影响。但不容忽视的是,关于CRISPR,还存在着诸多未解之谜。
谜题一:它来自哪里?
CRISPR-Cas等系统的生物学优势非常明显。原核生物——细菌和不太知名的、多数生活在极端环境、名为古生菌的单细胞生物——时刻面临基因侵略者的袭击。病毒的数目是原核生物的10倍,并且据说它们每隔一天便能剿灭世界上一半的细菌。原核生物会交换名为质粒的DNA碎片。质粒可以寄生在宿主中,并吞噬宿主的资源。当宿主试图将其排除胞外时,质粒就会驱使宿主启动自毁程序。基因侵入者简直是无处不在,土地、海洋,甚至是最不适宜生存的环境都遍布它们的身影。
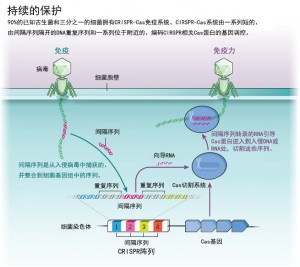
为了应对这些威胁,原核生物进化出了一系列武器,例如限制性内切酶,这是一种在特定序列处或附近切割DNA的蛋白。但这些防御系统并不灵敏。每种酶都会被编程为只识别某些特定序列,并且只有当微生物具有合适的基因拷贝时才能获得它的保护。相比之下,CRISPR-Cas更具动态性,能像人类感染后抗体发挥长效免疫保护机制一样,识别并记住特定的基因入侵者,当再次面临入侵时,迅速启动免疫响应。荷兰瓦赫宁根大学(Wageningen University)的微生物学家John van der Oost指出,当第一次听到这个假说时他们认为,这对于简单的原核生物来说,太过复杂了。
Mojica等人发现CRISPR的回文重复序列间的间隔序列有时会与病毒基因组的序列相匹配,随后他们对CRISPR-Cas的功能进行了解析。从那时起,研究人员发现,细菌和古生菌暴露于特定病毒或质粒后,某些CRISPR相关蛋白(Cas蛋白)会把这些间隔序列插入细菌和古细菌的基因组中。随后由这些间隔序列转录的RNA就会引导其它Cas蛋白切断与该间隔序列匹配的入侵DNA或RNA。
细菌和古生菌如何拥有这种复杂的免疫系统?这个问题尚未得到回答,但主流的理论是CRISPR系统来自转座子——“跳跃基因”(可以从基因组中的一个位置跳到另一个位置)。美国国立卫生研究院(NIH)的进化生物学家Eugene Koonin等人发现了一类编码Cas1蛋白的可移动元件。Cas1参与了将间隔序列插入基因组的过程。这些转座子元件可能是CRISPR-Cas免疫作用的起源。研究人员现在正在努力解析这些DNA如何实现“跳跃”——然后跟踪这种机制如何一步步演化成CRISPR-Cas这种复杂的机制。
谜题二:CRISPR系统如何发挥作用?
很多研究解析了Cas蛋白添加间隔序列的分子细节。但病毒DNA在化学上几乎与宿主DNA相同。在含有DNA的细胞中,Cas蛋白怎么辨别哪些DNA序列需要被添加到“基因库”呢?
如果一种细菌不慎添加了自己的DNA,它可能会通过自身免疫自杀。正如立陶宛维尔纽斯大学(ilnius University)的生物化学家Virginijus Siksnys表示,这些酶是一把双刃剑。
北卡罗来纳州立大学(North Carolina State University)的微生物学家Rodolphe Barrangou指出,一种可能是细菌和古细菌群体可以学习错误,吸取教训。如果部分细胞的自杀,能让其它细菌存活下来,这对于细菌群体来说,还是有很大意义的。
事实上,当病毒浸润细菌生态系统时,通常1000万个细菌中只有一个能获得一个正确的间隔序列,抵御病毒入侵。这种低概率带来的一个问题是,科学家们很难研究驱动间隔序列获取(spacer acquisition)机制的因素,而且难以搞明白为什么其它细胞失败,而那一个细胞却会成功。就像纽约市洛克菲勒大学(Rockefeller University)微生物学家Luciano Marraffini说的那样,你很难从一群细胞中捕获到那个正在获得间隔序列的细胞。
解析间隔序列的识别机制,提高这些序列整合到细菌基因组中的速率或许有助于解答这个谜题。一些工作表明,含有CRISPR-Cas的细胞有一种记录机制,会对遇到的DNA和RNA序列进行分类。研究人员或许可以利用这种记录机制,追踪细胞的基因表达和对环境化学物质的暴露情况。
研究人员还想知道的是,细菌如何排除“旧记忆”,避免重复添加序列。大多数具有CRISPR-Cas系统的细菌含有几十个间隔序列,当然也有一些只有一个。而古生菌Sulfolobus tokodaii将其基因组的1%专用于存储5个CRISPR-Cas系统,其中间隔序列一共有458个。
保留旧的间隔序列或许意义不大:如果病毒为避开CRISPR-Cas系统而发生突变,那么原有的间隔序列就不再有用,而额外的DNA对细菌也是一种负担。以色列Rehovot Weizmann科学研究所遗传学家Rotem Sorek指出,一种细菌不能永久地扩张基因组。因此及时清理无用的间隔序列非常必要。
谜题三:还有其它作用吗?
一些间隔序列的起源带出了另一个谜题。目前观察到的间隔序列中,只有不到3%与DNA数据库中的任何已知序列匹配。
一种可能是,我们的DNA数据库中病毒的DNA数据相对匮乏。毕竟大部分测序工作主要集中在那些会感染人、牲畜或作物的病毒上。乔治亚大学(University of Georgia)的RNA生物学家Michael Terns表示,我们对细菌的敌人——病毒,尤其是古生菌的敌人知之甚少。
另一种可能是,一些间隔序列靶向的是已经不存在、或突变到难以认出的病毒的DNA序列。但目前科学家们还不能排除第三种可能。研究人员已经发现CRISPR-Cas系统具有抵御病毒入侵之外的功能。在一些细菌中,CRISPR-Cas可以控制DNA修复、基因表达和生物膜的形成。它们还可以决定细菌的感染力:Legionella pneumophila,一种引起军团病的细菌,必须有Cas2才能感染其天然宿主——变形虫。伍斯特大学医学院(University of Massachusetts Medical School)的分子生物学家Erik Sontheimer指出,一个很重要的问题是,CRISPR系统还有什么其它生理功能。未来几年,这些问题都会被一一解答。
Sontheimer补充表示,CRISPR的发现和RNA干扰一样让人激动。RNA干扰是一种发生于动物、植物和其它非原核生物中的、沉默基因表达的系统。最初,RNA感染也被认为是防御机制,直到后来研究人员才注意到它在调控宿主基因表达上的作用。
荷兰代尔夫特理工大学(Delft University of Technology)的微生物学家Stan Brouns指出,这也可以解释为什么一些间隔序列和已知的病毒序列不匹配的原因。他表示,这些系统并不完美——它们会捕获病毒的DNA,但也会捕获自身的DNA。在没有发生自身免疫死亡的情况下,这些系统捕获新的DNA片段,就会获得新的功能。
谜题四:为什么只有部分微生物使用CRISPR?
无论CRISPR-Cas还有什么其它功能,显然只有部分微生物使用该系统。Koonin指出,90%的古生菌具有基于CRISPR的免疫系统,而只有约三分之一的已被测序的细菌有CRISPR系统。并且目前没有发现任何非原核生物,甚至单细胞生物,拥有CRISPR系统。
一种被称为Nanoarchaeum equitans的古生菌寄生于另一种生活在接近沸水的环境中的古生菌上。Nanoarchaeum equitans的基因组中删除了与能量产生和常见细胞管理相关的基因。然而,在其微小的、仅包含490000碱基的DNA中,含有30个间隔序列。对此,英国圣安德鲁斯大学(University of St Andrews)的分子生物学家Malcolm White指出,这也就是说,N. Equitans基因组的很大一部分都用在了CRISPR系统上。因此,CRISPR的重要性肯定远远超过能量产生和细胞管理,但他们还不知道具体细节。
英国埃克塞特大学(University of Exeter)的微生物学家Edze Westra认为,这种差异表明,在这种生态因素中,CRISPR的抵御病毒或其它作用的利处远大于细胞自杀的风险。极端环境似乎有利于CRISPR-Cas系统,但Westra指出,CRISPR系统的出现频率也会随着细菌生存环境的改变而改变。例如,一种禽类病原体鸡毒支原体(Mycoplasma gallisepticum)从鸡转到雀类身上时,就会丢失CRISPR系统。为什么这个系统在鸡中很有用,在雀类身上就没用?目前答案还不清楚。
数学模型和一些早期的实验室实验表明,当只有几种类型的病毒竞争时,CRISPR-Cas可能更有优势。CRISPR-Cas间隔序列的数目过多,会成为细菌的负担。Konnin指出,如果环境中的病毒的多样性大大超过可能的间隔序列的数量,那么CRISPR系统就没什么作用。另一种可能性是,在极端环境中的古生菌无法严重依赖其它防御手段。细菌阻止入侵者的一种常见方式是突变包膜(细菌外壳的组成成分)的蛋白质。由于包膜结构对于生物在恶劣条件下的生存至关重要,因此极端条件下生存的古生菌无法采用改变包膜结构的方式抵御病毒。Mojica认为,这种情况下,CRISPR等替代系统就显得尤为重要了。
谜题五:存在多少种CRISPR-Cas?
科学家们喜欢CRISPR-Cas9系统,主要是因为该系统在基因编辑上的简单通用性。但微生物并不喜欢,相反,它们倾向于混合和匹配不同的系统,迅速从其它细菌学习新系统,并抛弃旧系统。
研究人员已正式认可了6种不同类型,包括19种亚型的CRISPR系统。Marraffini表示,他们只知道其中很小一部分的机制。
揭开这些机制,可能是挖掘CRISPR-Cas系统新型应用潜能的关键。例如,最常用的CRISPR-Cas9是II型系统,其使用由间隔序列转录的RNA分子指导Cas酶切割入侵的病毒或质粒DNA。但是在去年发现的VI型CRISPR系统切割的则是RNA,而非DNA。IV型系统包含一些与CRISPR-Cas相关的基因,但缺乏重复和插入间隔序列的机制。
III型系统是自然界中最常见的CRISPR-Cas系统之一,但也是了解得最少的系统。目前证据表明,它们并不对侵入DNA或RNA本身产生响应,而是对DNA转录成RNA的过程产生响应。Doudna指出,如果真是如此,那么这是一种新的调控形式,可以成为新的基因编辑工具。
其它CRISPR系统也有可能出现,尤其是在研究者们的搜索范围从培养菌株扩大到了环境DNA样本的情况下。van der Oost指出,有好几次,他们都以为已经发现了所有的CRISPR系统了,直到又发现新的系统。
对于Mojica来说,他更着迷的是探索CRISPR的多样性和回答CRISPR系统的基本问题,而不是CRISPR引起的技术革命。他表示,很多同事对他的选择深感不解。25年来,他一直沉浸在CRISPR-Cas的世界里,虽然有很多资金涌向了研究CRISPR基因编辑技术,但是他得到的资金支持却非常少。
Mojica指出,他知道这是一个伟大的、神奇的工具。它可用于治疗疾病。但这不是他感兴趣的地方。Mojica想知道的是CRISPR系统的发生及发展机制。
原文检索:
Heidi Ledford. (2017) Five big mysteries about CRISPR’s origins. Nature, 541 (1038): 280-282.
张洁/编译